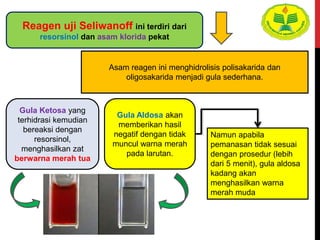
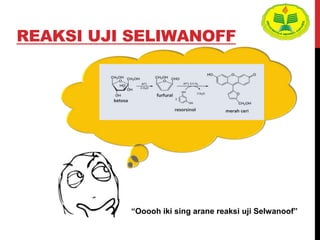
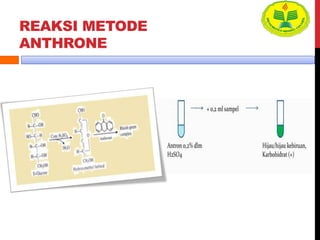
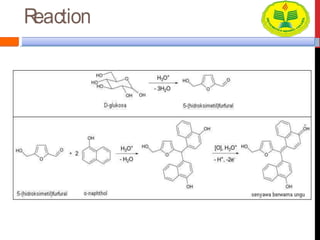
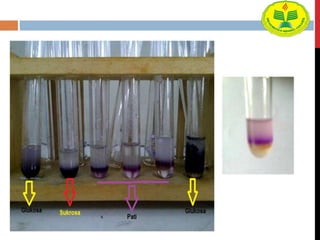
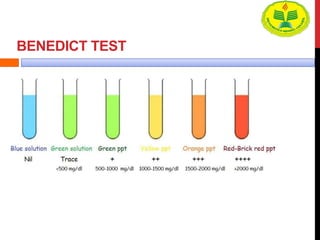
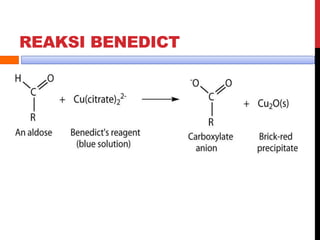
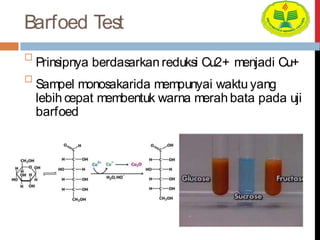
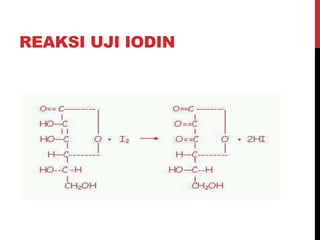
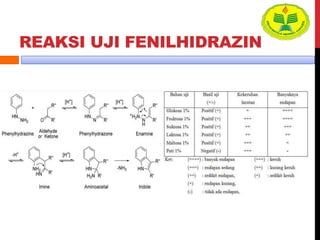
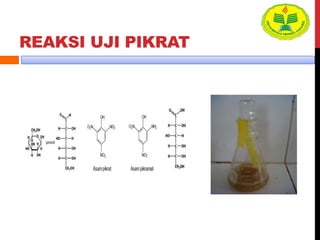
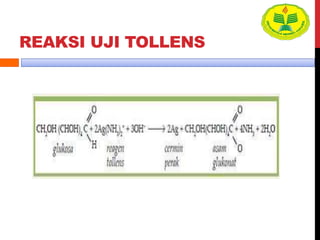
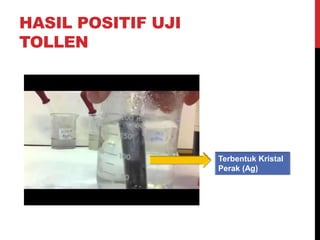
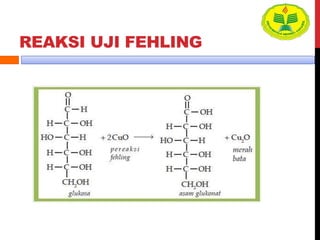
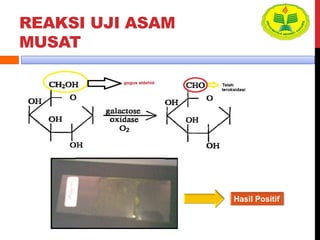
Dokumen ini menjelaskan berbagai uji untuk menentukan karbohidrat, termasuk uji Seliwanoff, Iodin, Benedict, Tollens, dan Fehling, serta perbedaan antara aldosa dan ketosa. Setiap metode uji memiliki prinsip dasar dan hasil yang menunjukkan keberadaan atau jenis karbohidrat, seperti reaksi warna yang dihasilkan dari interaksi dengan reagen tertentu. Selain itu, metode analisis seperti anthrone dan pemisahan dengan asam sulfat juga dibahas untuk memahami struktur karbohidrat.