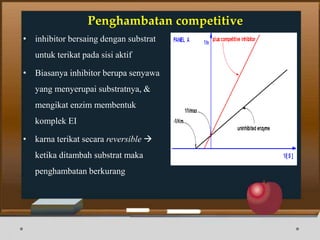
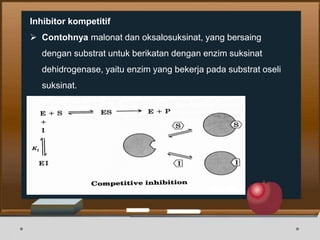
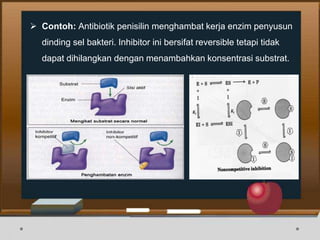
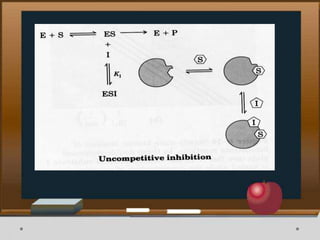
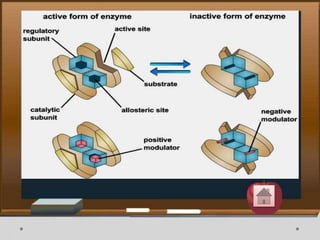
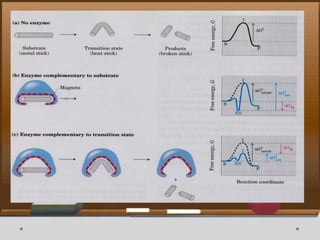
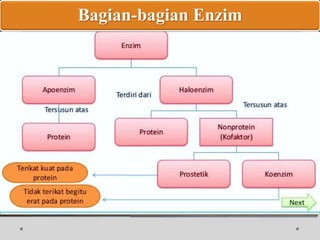
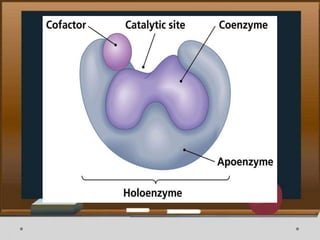
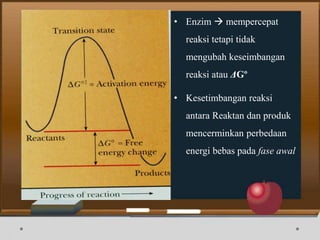
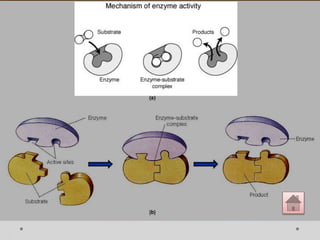
Dokumen ini menjelaskan tentang enzim, termasuk definisi, bagian-bagian, klasifikasi, dan karakteristiknya sebagai biokatalisator dalam reaksi kimia. Berbagai jenis enzim dan faktor yang mempengaruhi aktivitasnya seperti suhu, pH, dan inhibitor juga diuraikan. Selain itu, enzim berperan penting dalam proses biologis, industri, dan diagnosis medis.



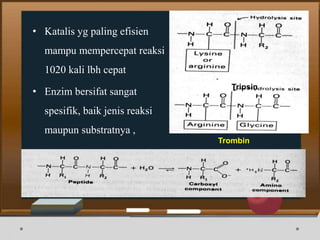













![6. Ligase
• Terjadi pembentukan ikatan C-C, C-S, C-O dan C-N
• Contoh Enzim : Acetone Carboxylase
• Contoh Inhibitor : ( + ) - p – [ 1 – ( p – text –
butylpheny) ] – 2 – oxo – 4 – pyrro
• Mekanisme reaksi : ATP + acetyl – CoA + HCO3 - +
H+ = ADP + phosphate + malonyl -
CoA](https://image.slidesharecdn.com/enzimfix-170430053618/85/Enzim-Nadya-dan-Intan-21-320.jpg)














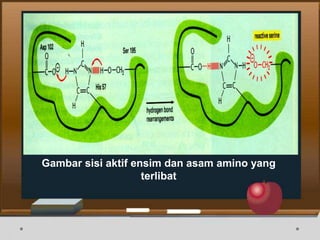

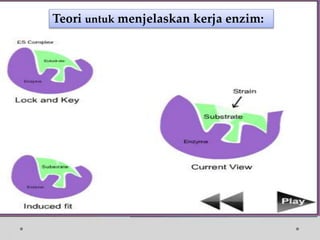

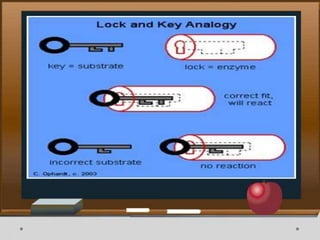

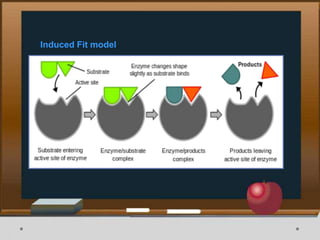

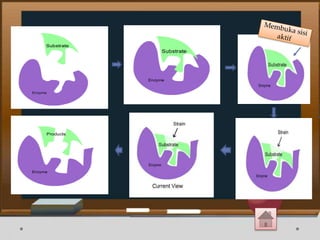


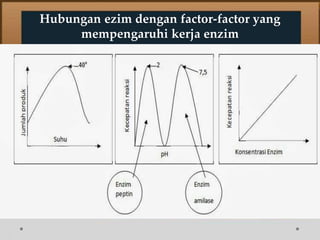
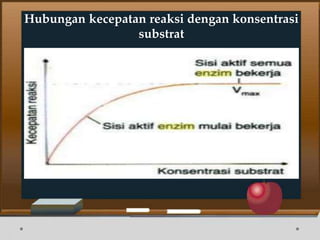

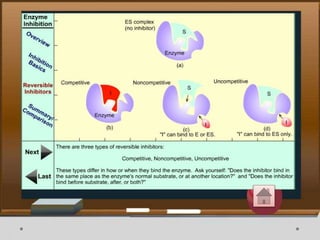
![Contoh Penghambatan Reaksi Enzimatis
Inhibitor enzim baik yang bersifat reversible atau irreversible
Contoh: Dapat digunakan untuk memperlambat laju kerusakan
makanan terutama pada makanan mentah. Makanan mentah dapat
rusak karena reaksi enzim dari mikroorganisme atau dari jaringan
makanan itu sendiri. Inhibitor enzim dapat menghambat kerja
enzim sehingga masa simpan makanan bertambah lama.[5]](https://image.slidesharecdn.com/enzimfix-170430053618/85/Enzim-Nadya-dan-Intan-52-320.jpg)