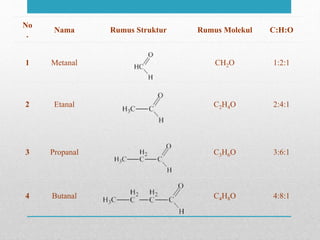
Berdasarkan hasil reaksi identifikasi yang diberikan, senyawa dengan rumus C3H6O tersebut adalah aldehida.
1. Dengan pereaksi Fehling menghasilkan endapan merah bata, menunjukkan adanya gugus aldehida.
2. Oksidasi menghasilkan senyawa yang dapat memerahkan lakmus biru, yaitu asam karboksilat, menunjukkan bahwa senyawa awal adalah aldehida.
Oleh karena itu, gugus