Dokumen ini membahas kinetika kimia, termasuk teori tumbukan dan keadaan transisi, hukum laju reaksi, serta faktor-faktor yang mempengaruhi laju reaksi seperti konsentrasi, suhu, dan penggunaan katalis. Juga dijelaskan berbagai contoh dan perhitungan yang melibatkan orde reaksi serta mekanisme reaksi dengan enzim sebagai katalis. Kinetic principles and various case studies detail how reactions progress and factors influencing reaction rates.


![9.1 TEORI TUMBUKAN DARI
LAJU REAKSI
• LAJU REAKSI BERBANDING LURUS:
- FREKUENSI TUMBUKAN (x)
- FRAKSI MOLEKUL TERAKTIFKAN (f)
- PELUANG UNTUK BERTUMBUKAN (p)
Reaksi : A + B C+D
Laju reaksi = f. p. x = f. p. [A].[B]
= k. [A].[B]](https://image.slidesharecdn.com/bab9-kinetikakimia-130204215635-phpapp01/85/Bab9-kinetika-kimia-3-320.jpg)
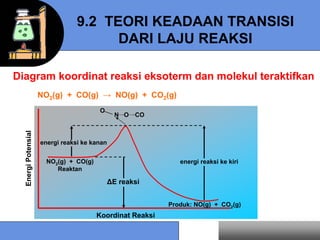
![9.3 HUKUM LAJU REAKSI
NO2(g) + CO(g) NO(g) + CO2(g)
Laju reaksi • Laju pengurangan konsentrasi reaktan terhadap waktu
• Laju kenaikan konsentrasi produk terhadap waktu
Laju = - d[NO2] = - d[CO] = d[NO] = d[CO2]
dt dt dt dt
Reaksi umum : aA + bB cC + dD
1 d[A] 1 d[B] 1 d[C] 1 d[D]
Laju = - =- = =
a dt b dt c dt d dt](https://image.slidesharecdn.com/bab9-kinetikakimia-130204215635-phpapp01/85/Bab9-kinetika-kimia-5-320.jpg)
![Contoh 9. 1
Pada suhu tinggi, HI bereaksi menurut persamaan berikut:
2 HI(g) → H2(g) + I2(g)
Pada suhu 443°C laju reaksi meningkat seiring dengan meningkatnya
konsentrasi HI sebagai berikut:
[HI] (mol/L 0,0050 0,010 0,020
Laju (mol/L detik) 7,5 x 10-4 3,0 x 10-3 1,2 x 10-2
a. Tentukan orde reaksi dan tulislah hukum lajunya
b. Hitunglah tetapan laju dan nyatakan satuannya
c. Hitunglah laju reaksi untuk HI dengan konsentrasi 0,0020 M](https://image.slidesharecdn.com/bab9-kinetikakimia-130204215635-phpapp01/85/Bab9-kinetika-kimia-6-320.jpg)
![Penyelesaian
a. Hukum laju pada dua konsentrasi [HI]1 dan[HI]2yang berbeda
ialah:
n
laju1 = k([HI]1)n laju2 [HI]2
laju = k([HI] )n
2 2 laju = [HI]
1 1
n
3,0 x 10-3 = 0,010
7,5 x 10-4 0,0050
4 = (2)n n = 2
Hukum laju = k[HI]2](https://image.slidesharecdn.com/bab9-kinetikakimia-130204215635-phpapp01/85/Bab9-kinetika-kimia-7-320.jpg)
![b. Tetapan laju k dihitung dengan memasukan nilai pada set data
yang mana saja dengan menggunakan hukum laju yang sudah
ditetapkan. Misalnya, jika kita ambil set data pertama:
7, 5 x 10-4 mol L-1 s-1 = k(0,0050 mol L-1)2
Jadi, k = 30 L mol-1 s-1
c. Laju dapat dihitung untuk [HI] = 0,0020 M:
laju = k[HI]2 = (30 L mol-1 s-1)(0,0020 mol L-1)2
= 1,2 x 10-4 mol L-1 s-1](https://image.slidesharecdn.com/bab9-kinetikakimia-130204215635-phpapp01/85/Bab9-kinetika-kimia-8-320.jpg)
![Orde Reaksi
Reaksi Orde Nol
aA → Produk
Laju = k [A]n......n = orde reaksi (tidak berkaitan langsung dengan koefisien a)
-d[A] = k [A]0
dt
[A]
d[A] = -kdt
[A] – [A]0 = -kt
[A]0
Laju = k (orde nol)
Waktu (t)](https://image.slidesharecdn.com/bab9-kinetikakimia-130204215635-phpapp01/85/Bab9-kinetika-kimia-9-320.jpg)
![Laju yang berkaitan pada dua atau lebih unsur kimia yang
berbeda
aA + bB → Produk
1 d[A] 1 d[B]
Laju = - =- = - k [A]m [B]n
a dt b dt](https://image.slidesharecdn.com/bab9-kinetikakimia-130204215635-phpapp01/85/Bab9-kinetika-kimia-10-320.jpg)
![Reaksi Orde Pertama: Grafik: ln c vs t
N2O5(g) → 2NO2(g) + ½O2(g)
ln [N2O5]
Hukum laju = k [N2O5) Intersep = ln [N2O5]0
-d[N2O5] = k[N2O5]
dt
d[N2O5] = -kdt
Slope = - k
[N2O5]
Bila diintegrasikan
ln [N2O5]t – ln [N2O5]0 = -kt
[N2O5]t = [N2O5]0 e-kt
Waktu paruh, t½ = ln 2 = 0,6931 Waktu (t)
k k](https://image.slidesharecdn.com/bab9-kinetikakimia-130204215635-phpapp01/85/Bab9-kinetika-kimia-11-320.jpg)

![Penyelesaian
1. k = 0,693/t½ = 0,693/80 detik = 8,7 x 10-3 detik-1
2. Jika yang terurai 25% maka yang tersisa = 100% - 25% = 75%
[A]0
kt = 2,303 log
[A]t
(8,7 x 10-3) t = 2,303 (log 1,0/0,75)
t = 23 detik](https://image.slidesharecdn.com/bab9-kinetikakimia-130204215635-phpapp01/85/Bab9-kinetika-kimia-13-320.jpg)
![Reaksi Orde Kedua:
Untuk reaksi 2NO2(g) → 2NO(g) + O2(g)
Hukum lajunya = k [NO2]2
-d[NO2] = k[NO2]2
dt
(L mol-1)
d[NO2] = -kdt
[NO2]2
[NO2]
1
Bila diintegrasikan Slope = 2 k
1 = 1 + 2 kt
[NO2]t [NO2]0
2 = koefisien stoikiometri dari NO2
Waktu (t)](https://image.slidesharecdn.com/bab9-kinetikakimia-130204215635-phpapp01/85/Bab9-kinetika-kimia-14-320.jpg)
![Reaksi Orde Pertama Semu
Merupakan reaksi orde kedua atau orde yang lebih tinggi tapi
mengikuti reaksi orde pertama
Contoh: C + D hasil reaksi
Laju reaksinya = k [C] [D]
d[C]
- = k [C] [D]; bila k[D] tetap maka laju reaksinya = k’ [C]
dt
d[C]
atau - = k’ [C] dan k’ = k [D], k’= tetapan laju orde 1 semu
dt
dan waktu paruhnya (t ½) = 0,693/k’](https://image.slidesharecdn.com/bab9-kinetikakimia-130204215635-phpapp01/85/Bab9-kinetika-kimia-15-320.jpg)
![Contoh 9. 3
Reaksi radikal OH- dengan metana di atmosfir mempunyai konstanta
laju reaksi pada suhu 25oC sebesar 6,3 x 10-15 mol/L detik.
Reaksinya: OH- (g) + CH4 (g) H2O (g) + CH3- (g)
1. Tentukan hukum laju reaksi orde pertama semu jika OH- konstan
dan hitunglah k’ jika [OH-] = 1,2 x 106 mol/L
2. Hitunglah waktu paruh metana bila [OH-] = 1,2 x 106 mol/L](https://image.slidesharecdn.com/bab9-kinetikakimia-130204215635-phpapp01/85/Bab9-kinetika-kimia-16-320.jpg)
![Penyelesaian
1. Laju reaksi = k [OH-] [CH4]
karena [OH-] konstan maka konstanta laju reaksi = k’
laju reaksi menjadi = k’ [CH4]; dan k’ = k [OH-]
k’ = (6,3 x 10-15 mol/L detik) (1,2 x 106 mol/L)
= 7,6 x 10-9 detik-1
2. t½ = 0,693/k’ = 0,693/ 7,6 x 10-9 detik-1 = 2 tahun 11 bulan](https://image.slidesharecdn.com/bab9-kinetikakimia-130204215635-phpapp01/85/Bab9-kinetika-kimia-17-320.jpg)

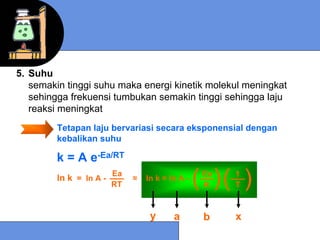

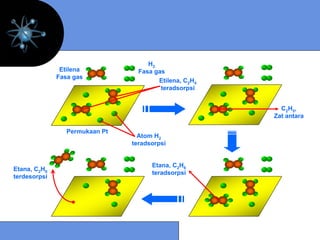
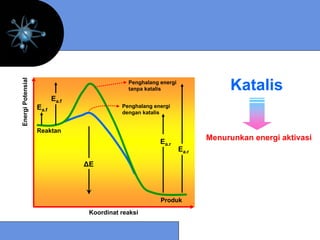
![9.5 MEKANISME REAKSI
Mekanisme reaksi menyatakan jenis dan jumlah tahap
pada suatu reaksi
Reaksi Elementer
Unimolekular : N2O5* → NO2 + NO3
laju = k [N2O5*]
Bimolekular : NO(g) + O3(g) → NO2(g) + O2(g)
laju = k [NO] [O3]
Termolekular : I + I + Ar → I2 + Ar
laju = k [ I ]2 [Ar]
laju = k [ I ]2](https://image.slidesharecdn.com/bab9-kinetikakimia-130204215635-phpapp01/85/Bab9-kinetika-kimia-23-320.jpg)




![LATIHAN SOAL-SOAL
1. Dalam mengkaji reaksi piridina (C5H5N) dengan metil iodida (CH3I)
dalam larutan benzena, berikut ini adalah data laju reaksi awal yang
diukur pada suhu 25oC untuk berbagai konsentrasi awal dari dua
reaktan:
[C5H5N] (mol/L) [CH3I](mol/L) Laju(mol/L detik)
1,00 x 10-4 1,00 x 10-4 7,5 x 10-7
2,00 x 10-4 2,00 x 10-4 3,0 x 10-6
2,00 x 10-4 4,00 x 10-4 6,0 x 10-6
a. Tentukan hukum laju untuk reaksi ini
b. Hitunglah konstanta laju dan nyatakan satuannya
c. Hitunglah laju reaksi untu larutan dengan [C5H5N] 5,0 x 10-5 M
dan [CH3I] 2,0 x 10-5 M](https://image.slidesharecdn.com/bab9-kinetikakimia-130204215635-phpapp01/85/Bab9-kinetika-kimia-28-320.jpg)


