Tiga kalimat ringkasan dokumen tersebut adalah:
1. Dokumen tersebut menjelaskan berbagai jenis kerja dalam termodinamika seperti kerja mekanik, ekspansi, gravitasi, permukaan, dan listrik.
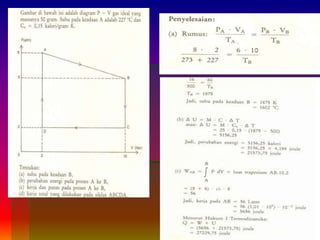
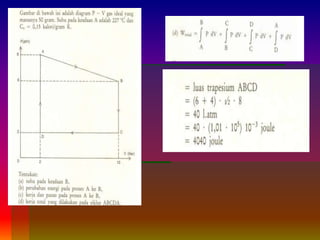
2. Metode penghitungan kerja total dengan mengintegrasikan persamaan kerja dan contoh soal penerapannya.
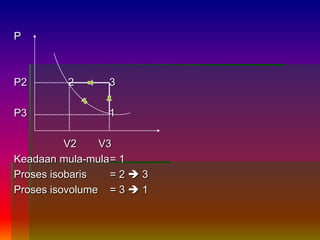
3. Dibahas pula proses-proses dalam termodinamika seperti isovoume, isobaris, isot








![Latihan:
Berapa kerja yang dilakukan terhadap sistem jika satu mol gas
ideal pada 300 k dikompres secara isotermal dan reversibel
menjadi seperlima dari volume semula?
Diket : N= 1mol, T=300 k, V2=1/5
Jwb : w = nRT.in v2/v1
= ( 1 mol ) ( 8,314 J K-1mol-1)(300K) [in 1/5 v1/v1]
= 2494,2(-1,609)
= -4013,1678](https://image.slidesharecdn.com/7-140325080127-phpapp02/85/7-hk-pertama-termodinamika-9-320.jpg)