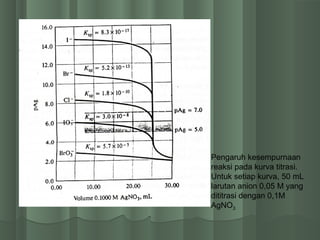
Dokumen ini membahas titrasi pengendapan argentometri menggunakan larutan perak nitrat, mencakup konsep dasar pengendapan, kurva titrasi, serta daerah perhitungan px. Empat daerah perhitungan px yang dibahas meliputi px mula-mula, sebelum titik ekivalen, pada titik ekivalen, dan setelah titik ekivalen. Selain itu, juga dijelaskan tiga metode titrasi berdasarkan indikator kimia yang digunakan: metode Mohr, Volhard, dan Fajans.



![ Contoh :Contoh :
HHitung pAg dari larutan pada titrasi 50 mitung pAg dari larutan pada titrasi 50 mLL NaCl 0,1 MNaCl 0,1 M
dengan AgNOdengan AgNO33 0,1 M setelah penambahan volume :0,1 M setelah penambahan volume :
0 m0 mLL; b. 20 m; b. 20 mLL; c.; c. 50 m50 mLL; d.60 m; d.60 mLL
(Ksp AgCl = 1,83 x 10(Ksp AgCl = 1,83 x 10-10-10
))..
a.a. Belum ada penambahan titrant AgNOBelum ada penambahan titrant AgNO33
--
, sehingga [Ag, sehingga [Ag++
]=0]=0
dandan pAg tidak dapat ditentukanpAg tidak dapat ditentukan..
b.b. Setelah penambahan 20 mSetelah penambahan 20 mLL AgNOAgNO33 0,1M0,1M
NaCl + AgNONaCl + AgNO33 ↔ AgCl↓ + NaNO↔ AgCl↓ + NaNO33
Mula mula 5 mmol 2 mmol 0 mmol 0 mmolMula mula 5 mmol 2 mmol 0 mmol 0 mmol
Reaksi 2 mmol 2 mmol 2 mmol 2 mmolReaksi 2 mmol 2 mmol 2 mmol 2 mmol
SisaSisa 3 mmol3 mmol 0 mmol0 mmol 2 mmol2 mmol 2 mmol2 mmol
Reaksi yg terjadi : NaCl + AgNO3 ↔ AgCl↓ + NaNO3
AgCl↓ ↔ Ag+
+ Cl-](https://image.slidesharecdn.com/materiargentometrippt5-171015230123/85/Titrasi-Pengendapan-4-320.jpg)
![ Belum mencapai TE,Belum mencapai TE,
[Cl- ][Cl- ]sisasisa = 3 mmol /(50+20)m= 3 mmol /(50+20)mLL = 0,043 M= 0,043 M
Adanya ClAdanya Cl--
dari NaCl pada pengendapan AgCldari NaCl pada pengendapan AgCl
(pengaruh ion senama)(pengaruh ion senama)
Ksp AgCl↓ = [Ag+][Cl-]Ksp AgCl↓ = [Ag+][Cl-]
[Ag+] = Ksp / [Cl-][Ag+] = Ksp / [Cl-]
[Ag+] = 1,82x10[Ag+] = 1,82x10-10-10
/ [0,043] = 4,23x10/ [0,043] = 4,23x10-9-9
pAgpAg = -log [4,23x10= -log [4,23x10-9-9
] =] = 8,378,37
c.c. Setelah penambahan 50Setelah penambahan 50 mmLL AgNOAgNO33 0,1M0,1M..
NaCl + AgNONaCl + AgNO33 ↔ AgCl↓ + NaNO↔ AgCl↓ + NaNO33
Mula mula 5 mmol 5 mmol 0 mmol 0 mmolMula mula 5 mmol 5 mmol 0 mmol 0 mmol
Reaksi 5 mmol 5 mmol 5 mmol 5 mmolReaksi 5 mmol 5 mmol 5 mmol 5 mmol
Sisa 0 mmol 0 mmolSisa 0 mmol 0 mmol 5 mmol5 mmol 5 mmol5 mmol](https://image.slidesharecdn.com/materiargentometrippt5-171015230123/85/Titrasi-Pengendapan-5-320.jpg)
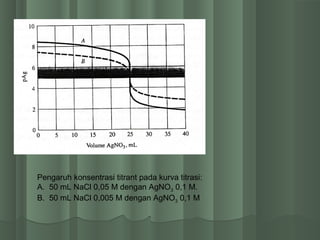
![ Titik ekivalen tercapai , [Ag+] = [Cl-]Titik ekivalen tercapai , [Ag+] = [Cl-]
Harga [Ag+] dihitung dari Ksp nya.Harga [Ag+] dihitung dari Ksp nya.
Ksp AgCl↓ = [Ag+][Cl-]Ksp AgCl↓ = [Ag+][Cl-]
[Ag+] =√ Ksp[Ag+] =√ Ksp
[Ag+] = √1,82x10[Ag+] = √1,82x10-10-10
== 1,35 x 101,35 x 10-5-5
pAgpAg = -log [1,35x10= -log [1,35x10-5-5
] =] = 4,874,87
dd.. Setelah penambahan 60 mL AgNOSetelah penambahan 60 mL AgNO3.3.
NaCl + AgNONaCl + AgNO33 ↔ AgCl↓ + NaNO↔ AgCl↓ + NaNO33
Mula mula 5 mmol 6 mmol 0 mmol 0 mmolMula mula 5 mmol 6 mmol 0 mmol 0 mmol
Reaksi 5 mmol 5 mmol 5 mmol 5 mmolReaksi 5 mmol 5 mmol 5 mmol 5 mmol
SisaSisa 00 mmol 1 mmol 5 mmolmmol 1 mmol 5 mmol 5 mmol5 mmol
Melewati TE,Melewati TE,
[Ag+ ][Ag+ ]sisasisa =1 mmol /(50+60)m=1 mmol /(50+60)mLL= 9,091x10= 9,091x10-3-3
MM
pAg =-log[9,091x10-3-3
]= 2,04](https://image.slidesharecdn.com/materiargentometrippt5-171015230123/85/Titrasi-Pengendapan-6-320.jpg)