Tiga kalimat ringkasan dokumen tersebut adalah:
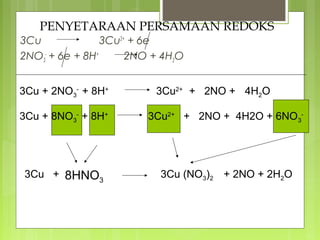
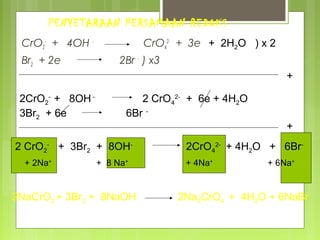
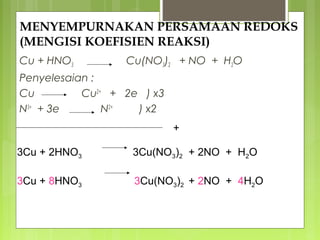
Dokumen tersebut membahas tentang reaksi redoks dan elektrokimia, mulai dari pengertian reaksi oksidasi dan reduksi, oksidator dan reduktor, bilangan oksidasi, penyetaraan persamaan redoks, dan jenis-jenis sel elektrokimia seperti sel galvanik dan sel elektrolisis.



























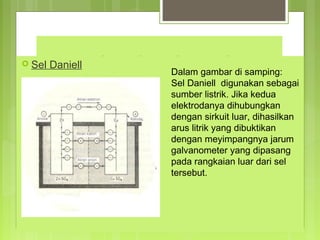






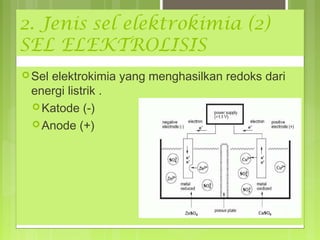






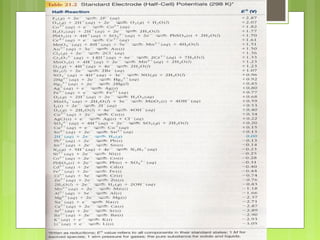
![Menghitung Potensial Elektroda
Sel
E° sel = E° red - E° oks
E sel = E° sel - RT/nF ln C
E sel = E° sel - 0.059/n log C
Pada T = 25° C
Catatan :
E° = potensial reduksi standar (volt)
R = tetapan gas - [ volt.coulomb/mol.°K] = 8.314
T = suhu mutlak (°K)
n = jumlah elektron
F = 96.500 coulomb
C = [bentuk oksidasi]/[bentuk reduksi]](https://image.slidesharecdn.com/redokselektrokimia-131120044350-phpapp01/85/Redoks-elektrokimia-46-320.jpg)