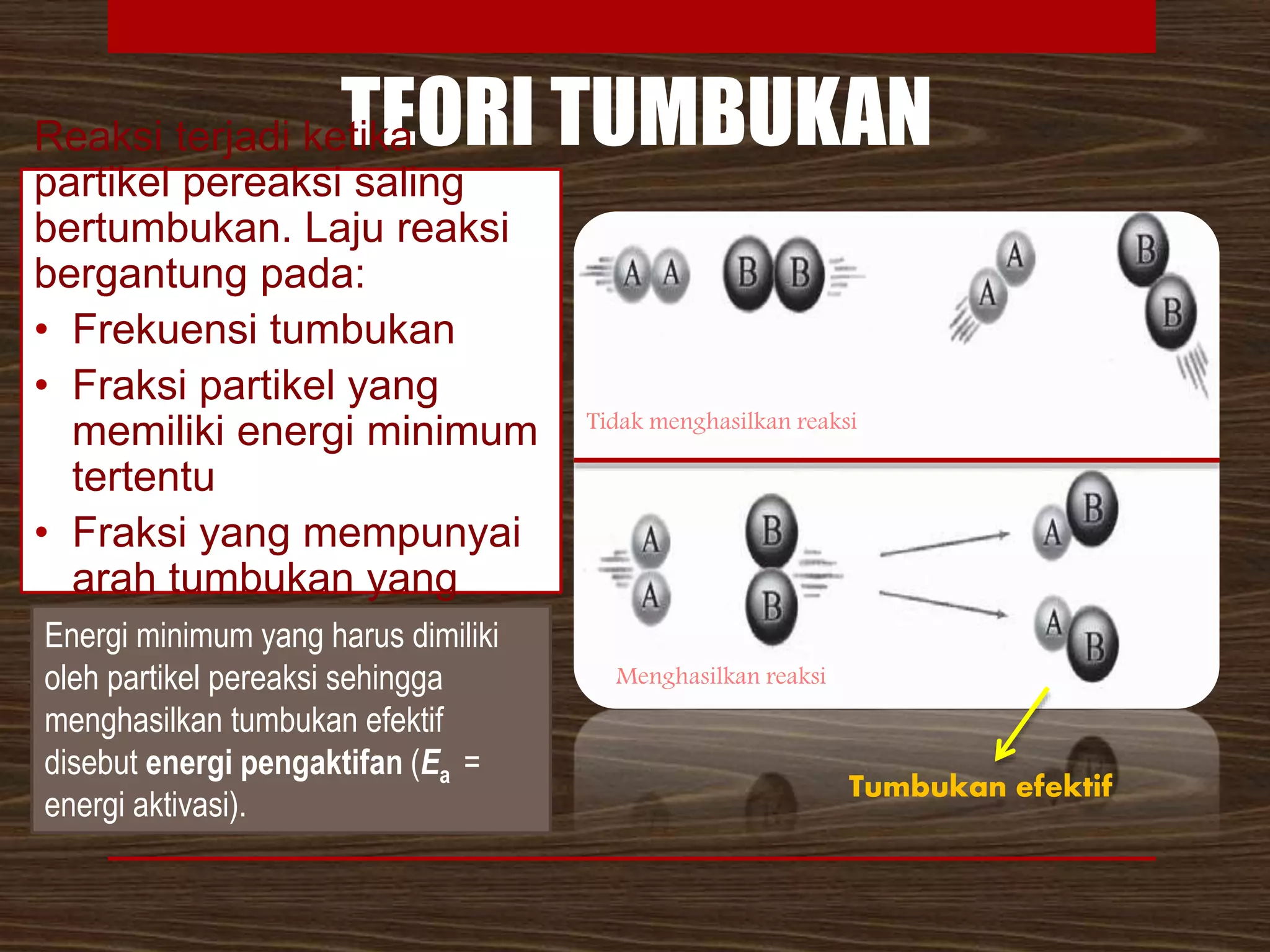
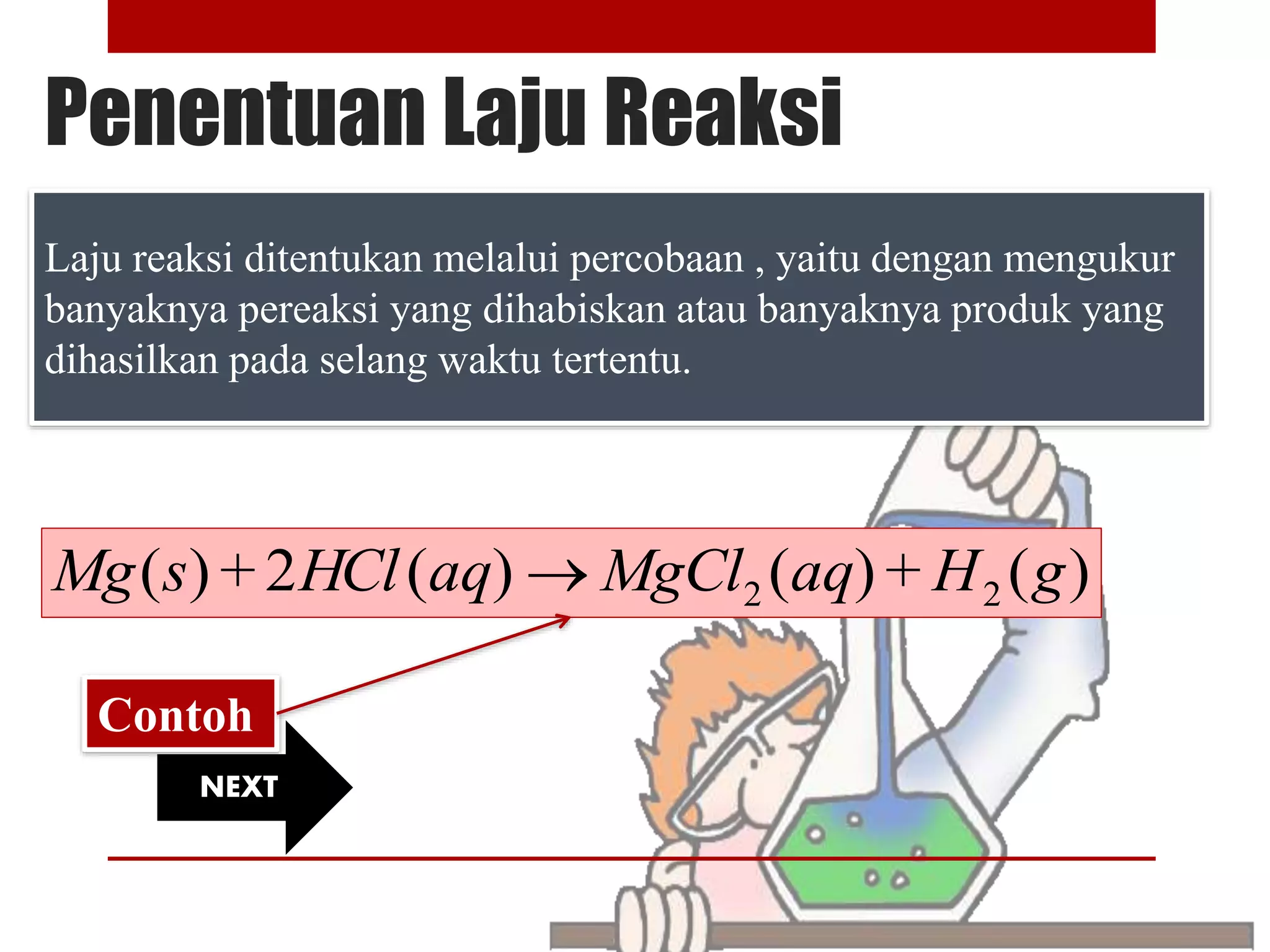
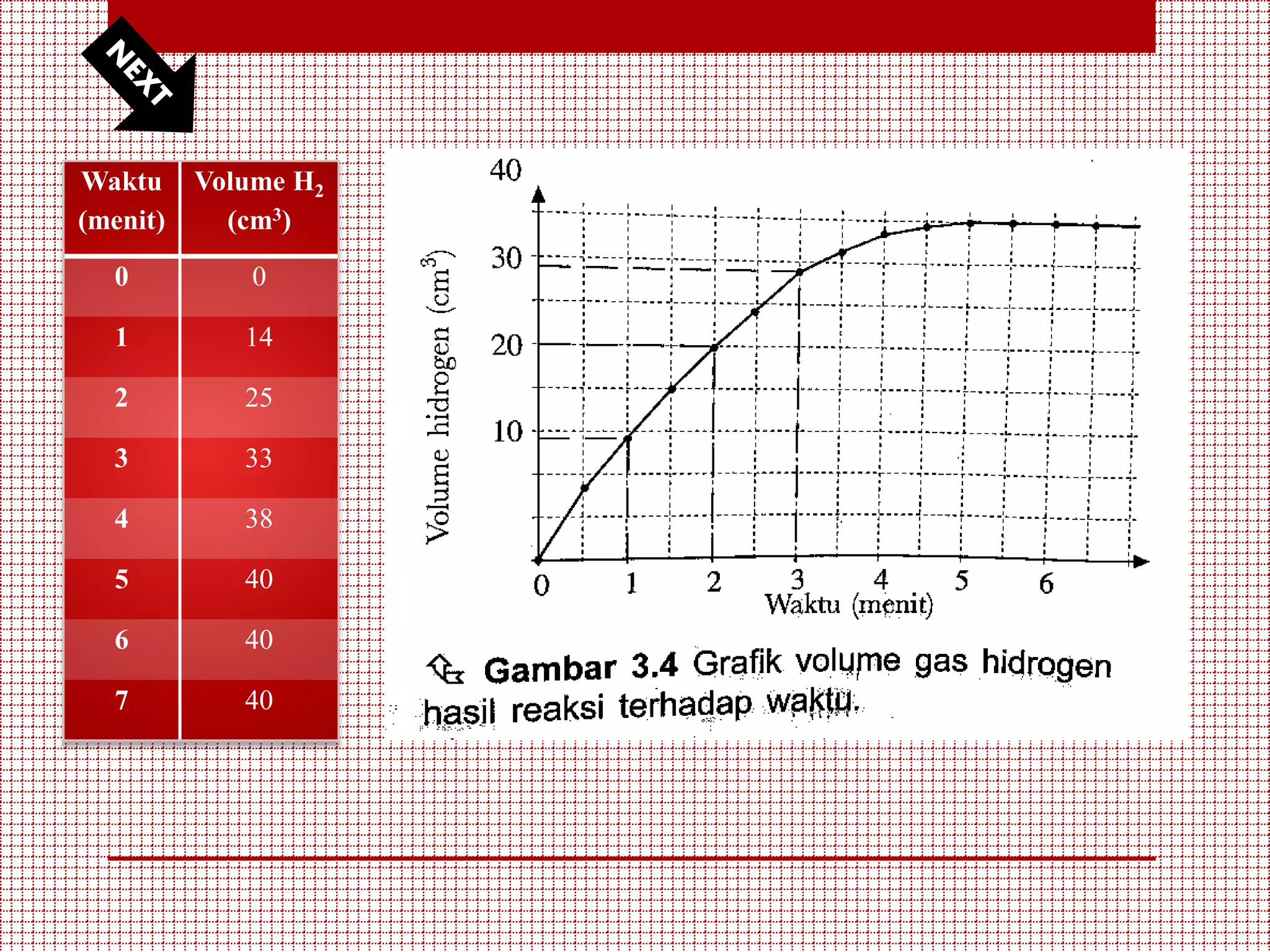
Dokumen ini membahas tentang laju reaksi kimia di kelas XI, mencakup pengertian, faktor-faktor yang mempengaruhi laju reaksi, serta aplikasinya dalam kehidupan sehari-hari dan industri. Materi mencakup metode eksperimen, teori tumbukan, konsep kemolaran, dan persamaan laju reaksi. Selain itu, faktor-faktor seperti konsentrasi, suhu, luas permukaan, dan penggunaan katalis dijelaskan untuk menggambarkan pengaruhnya terhadap laju reaksi.








![nPmR
t
R
v
][
atau
t
P
v
][
Keterangan:
R = pereaksi (reaktan)
P = produk
v = laju reaksi
t = waktu reaksi
= perubahan konsentrasi molar pereaksi
= perubahan konsentrasi molar produk
][R
][P](https://image.slidesharecdn.com/lajureaksielrarepi-161214125827/75/Laju-Reaksi-ppt-12-2048.jpg)
![Untuk reaksi:
Laju reaksi dapat dinyatakan sebagai laju pengurangan
konsentrasi molar N2O5 atau laju pertambahan konsentrasi
molar NO2 atau laju pertambahan konsentrasi molar O2.
nyatakanlah laju reaksinya!
Jawab:
(g)O+(g)4NO(g)O2N 2252
t
O
t
NO
t
ON
t
O
t
NO
t
ON
v
sMv
sMv
sMv
O
NO
ON
][][
4
1][
2
1
][
][
][
2252
2
2
52
/
/
/
2
2
52
Contoh](https://image.slidesharecdn.com/lajureaksielrarepi-161214125827/75/Laju-Reaksi-ppt-13-2048.jpg)



![PERSAMAAN LAJU REAKSI
Hubungan kuantitatif antara konsentrasi pereaksi dengan laju reaksi
dinyatakan dalam suatu persamaan, yaitu persamaan laju reaksi.
DCBA qpnm
Untuk reaksi:
Persamaan laju:
v = k [A]x [B]y
Keterangan:
k = tetapan jenis reaksi
x = orde reaksi terhadap pereaksi A
y = orde reaksi terhadap pereaksi B](https://image.slidesharecdn.com/lajureaksielrarepi-161214125827/75/Laju-Reaksi-ppt-17-2048.jpg)
![][][
]][[
)(2)()(
]][[
)(2)()(
]][[
)()()()(
][
)()(4)(2
2
2
3
22
22
22
22
2
1
23
423
52
2252
HBrkBr
BrHk
gHBrgBrgH
IHk
gHIgIgH
ClCHClk
gHClgCClgClgCHCl
ONk
gOgNOgON
v
v
v
v
](https://image.slidesharecdn.com/lajureaksielrarepi-161214125827/75/Laju-Reaksi-ppt-18-2048.jpg)
![Orde reaksi menyatakan besarnya pengaruh konsentrasi
pereaksi pada laju reaksi.
a. Orde nol
Reaksi dinyatakn
berorde nol terhadap
salah satu pereaksinya
apabila perubahan
konsentrasi pereaksi
tersebut tidak
mempengaruhi laju
reaksi.
[X]
v](https://image.slidesharecdn.com/lajureaksielrarepi-161214125827/75/Laju-Reaksi-ppt-19-2048.jpg)
![b. Orde satu
Suatu reaksi dikatakan
berorde satu terhadap
salah satu pereaksinya
jika laju reaksi
berbanding lurus
dengan konsentrasi
pereaksi itu.
[X]
v
c. Orde dua
Suatu reaksi dikatakan
berorde dua terhadap
salah satu pereaksi jika
laju reaksi merupakan
pangkat dua dari
konsentrasi pereaksi
itu.
[X]
v](https://image.slidesharecdn.com/lajureaksielrarepi-161214125827/75/Laju-Reaksi-ppt-20-2048.jpg)


![Jawab:
Misal persamaan laju reaksi adalah v = k [NO]x[H2]y
a. Orde reaksi terhadap NO ditentukan dari percobaan 1 dan 2.
𝑣2
𝑣1
=
𝑘 12,8 × 10−3 𝑥
2,2 × 10−3 𝑦
𝑘 6,4 × 10−3 𝑥 2,2 × 10−3 𝑦
=
1,0 × 10−4
2,6 × 10−5
2 𝑥
= 4
𝑥 = 2
Jadi, orde reaksi terhadap NO = 2.
b. Orde reaksi terhadap H2 ditentukan dari percobaan 1 dan 3.
𝑣2
𝑣1
=
𝑘 6,4 × 10−3 𝑥
4,4 × 10−3 𝑦
𝑘 6,4 × 10−3 𝑥 2,2 × 10−3 𝑦
=
5,1 × 10−4
2,6 × 10−5
2 𝑦 = 2
𝑦 = 2
Jadi, orde reaksi terhadap H2 = 1.](https://image.slidesharecdn.com/lajureaksielrarepi-161214125827/75/Laju-Reaksi-ppt-23-2048.jpg)
![c. Persamaan laju reaksi : 𝑣 = 𝑘[𝑁𝑂]2[𝐻2]
d. Orde reaksi total = 2 + 1 = 3.
e. Dari persamaan laju reaksi:
𝑣 = 𝑘 𝑁𝑂 2[𝐻2]
Maka, 𝑘 =
𝑣
[𝑁𝑂]2[𝐻2]
Berdasarkan percobaan (1):
𝑘 =
2,6 × 10−5 𝑀 𝑠−1
6,4 × 10−3 𝑀 2(2,2 × 10−3 𝑀)
= 288,5 𝑀−2
𝑠−1
f. Persamaan laju reaksi lengakap:
𝑣 = 288,5 𝑁𝑂 2
[𝐻2]
Jika [NO] = 0,5 M; [H2] = 0,5 M,
Maka 𝑣 = 288,5 0,5 2
0,5 = 36,06 𝑀 𝑠−1](https://image.slidesharecdn.com/lajureaksielrarepi-161214125827/75/Laju-Reaksi-ppt-24-2048.jpg)