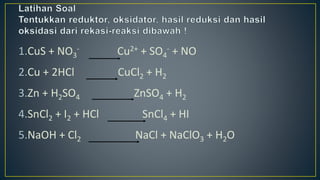
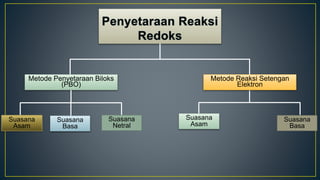
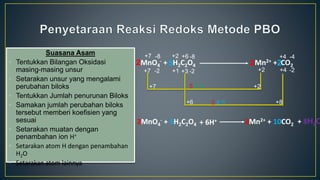
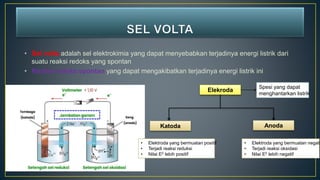
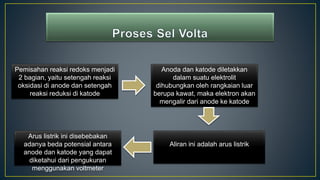
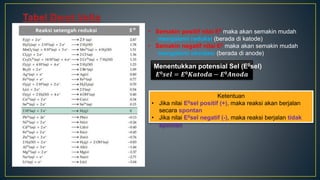
Dokumen ini menjelaskan tentang konsep reduksi dan oksidasi, termasuk pengertian, contoh dalam kehidupan sehari-hari, dan bilangan oksidasi unsur-unsur. Selain itu, dijelaskan juga mengenai penyetaraan reaksi redoks dan penerapannya dalam elektrokimia, termasuk sel volta dan hukum Faraday. Terdapat juga beberapa contoh soal untuk menentukan bilangan oksidasi dan menghitung massa zat yang terlibat dalam elektrolisis.