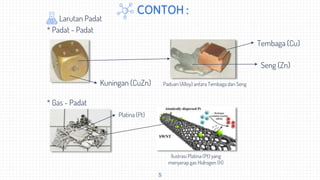
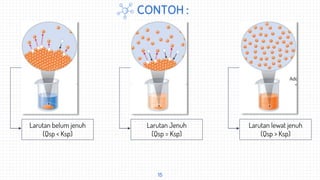
Dokumen ini memberikan definisi dan jenis-jenis larutan, serta menjelaskan komposisi larutan meliputi fraksi mol, molalitas, dan molaritas. Larutan didefinisikan sebagai campuran homogen yang terdiri dari zat terlarut dan pelarut. Jenis larutan mencakup elektrolit, non-elektrolit, jenuh, tidak jenuh, dan lewat jenuh. Komposisi larutan dapat diukur dengan fraksi mol, molalitas, dan molaritas.














![17
FRAKSI MOL (X)
“Menyatakan perbandingan antara jumlah mol salah satu
komponen larutan terhadap total semua komponen
dalam larutan”
XA =
𝐽𝑢𝑚𝑙𝑎ℎ 𝑚𝑜𝑙 𝑘𝑜𝑚𝑝𝑜𝑛𝑒𝑛 𝐴
𝐽𝑢𝑚𝑙𝑎ℎ 𝑚𝑜𝑙 𝑠𝑒𝑙𝑢𝑟𝑢ℎ 𝑘𝑜𝑚𝑝𝑜𝑛𝑒𝑛
Dinotasikan dengan :
Jika dalam larutan tersebut hanya terdiri dari dua
komponen [zat A (terlarut) dan zat B (larutan)], maka
berlaku :
𝑋 𝐵 = 1 − 𝑋𝐴
Khaerunnisa (2008) dalam Kimia Fisika 2
Sunarya (2012) dalam Kimia Dasar 2
Sumber :](https://image.slidesharecdn.com/larutan-individu-190210034426/85/Larutan-Kimia-Dasar-17-320.jpg)



