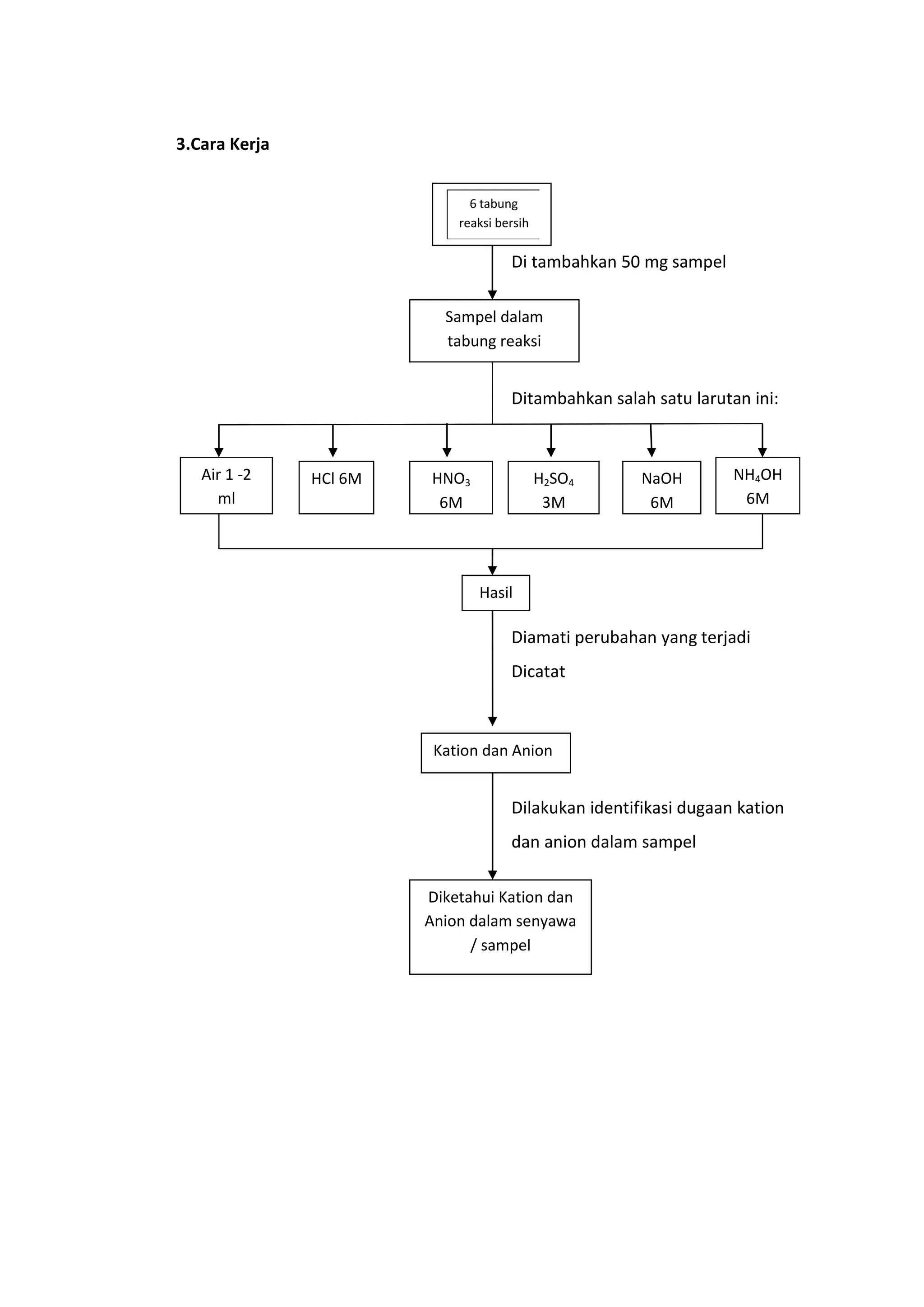
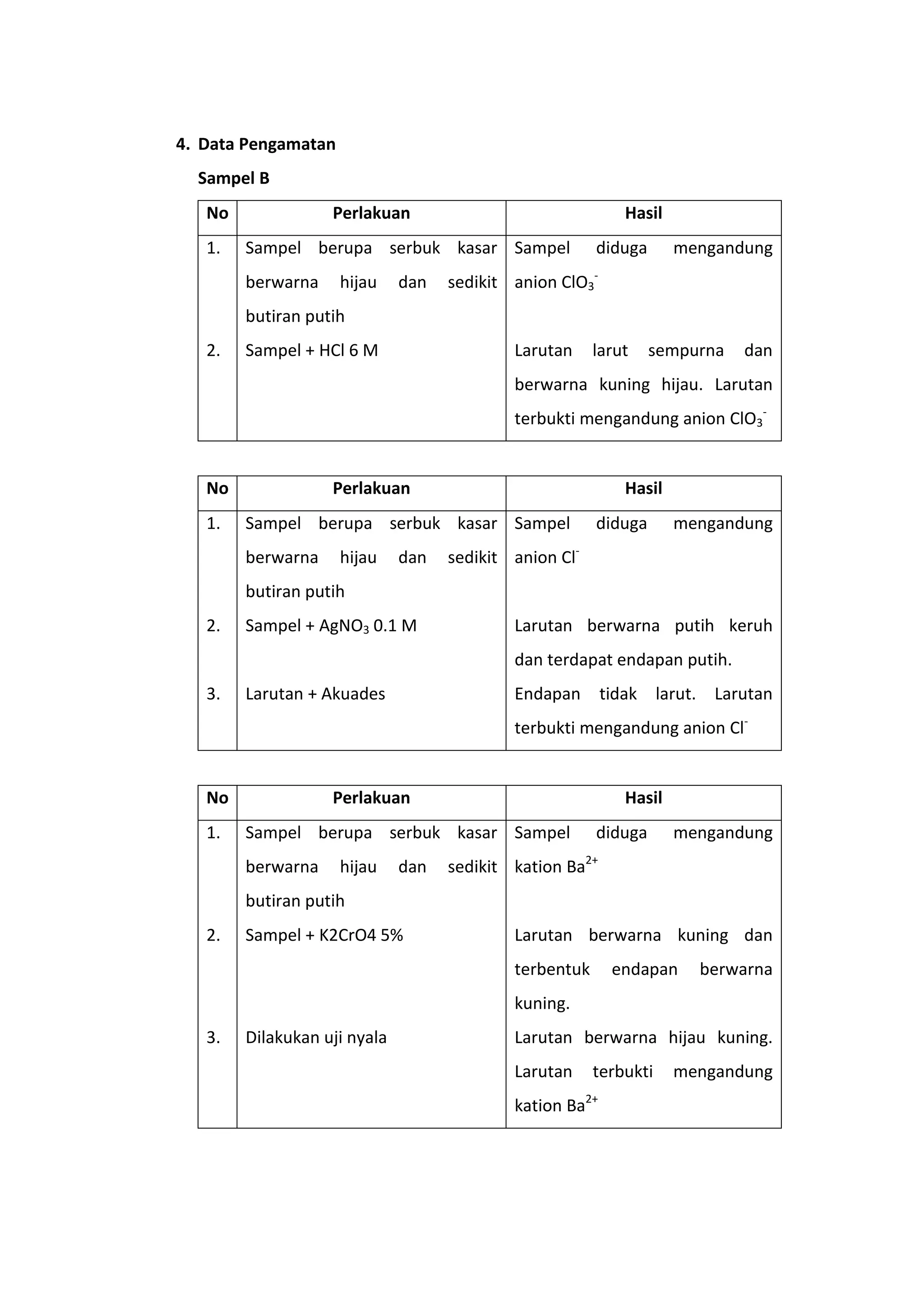
Dokumen ini membahas analisis kualitatif untuk mengidentifikasi anion dan kation dalam senyawa anorganik murni melalui sifat pembentukan endapannya, kelarutan, dan reaksi lainnya. Metode analisis meliputi reaksi kering dan basah, dengan penggunaan reagensia tertentu sesuai dengan klasifikasi kation yang ada. Hasil percobaan menunjukkan bahwa sampel yang dianalisis mengandung kation barium (Ba²⁺) dan timbal (Pb²⁺), serta anion klorat (ClO₃⁻) dan klorida (Cl⁻).