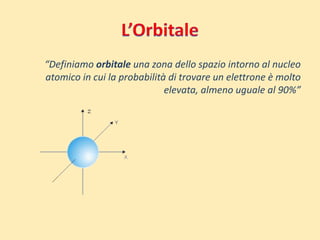
Il documento discute l'evoluzione della teoria atomica, introducendo la meccanica ondulatoria e la meccanica probabilistica, culminando nel modello quantistico. Viene menzionata l'ipotesi di De Broglie sulla dualità onda-particella e il principio di indeterminazione di Heisenberg, che limita la conoscenza simultanea di posizione e quantità di moto. Infine, l'equazione di Schrödinger è presentata come unione delle teorie precedenti, descrivendo gli orbitali come zone di alta probabilità di trovare un elettrone.