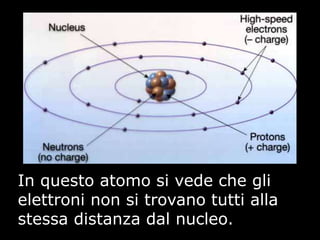
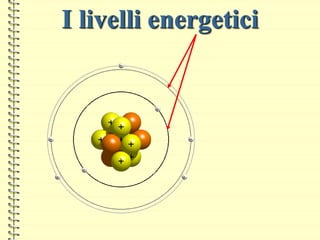
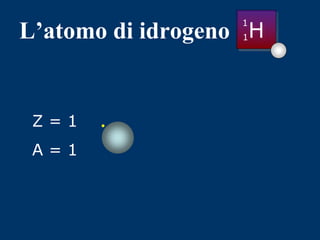
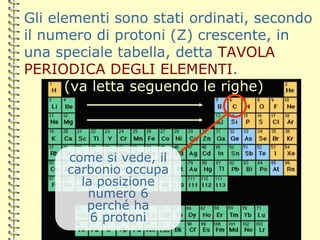
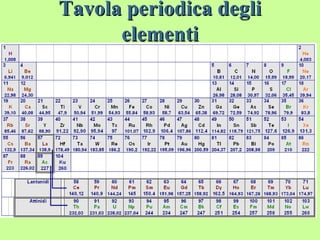
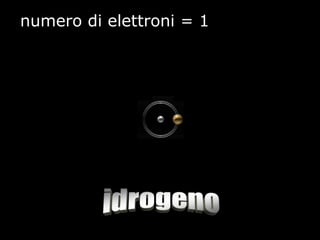
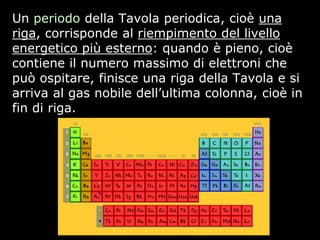
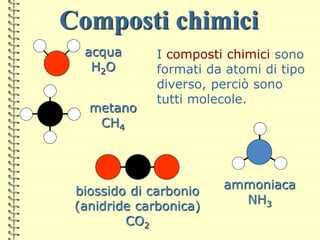
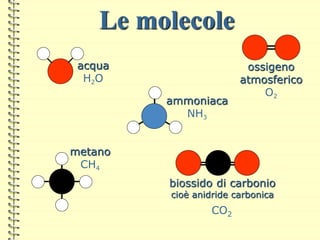
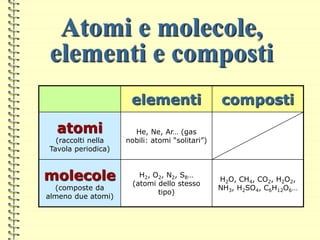
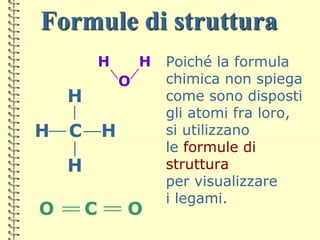
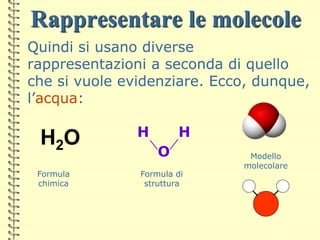
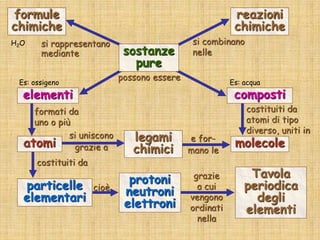
Il documento fornisce una panoramica su atomi e molecole, descrivendo elementi chimici, particelle subatomiche, numero atomico e peso atomico, e la disposizione degli elettroni. Viene spiegato come gli atomi possano legarsi attraverso legami chimici per formare molecole e composti chimici, illustrando anche l'importanza della tavola periodica. Infine, si enfatizza la rappresentazione degli atomi e delle molecole mediante formule chimiche e strutture.