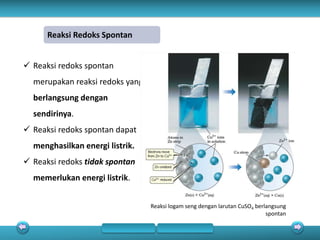
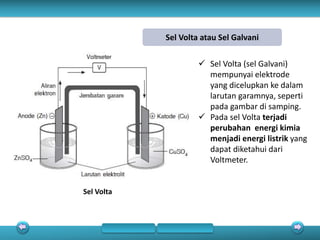
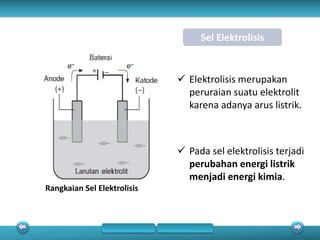
Dokumen tersebut membahas tentang beberapa topik reaksi redoks dan sel elektrokimia, termasuk: (1) reaksi redoks spontan yang menghasilkan energi listrik, (2) sel Volta yang mengubah energi kimia menjadi listrik, dan (3) sel elektrolisis yang mengubah energi listrik menjadi energi kimia.