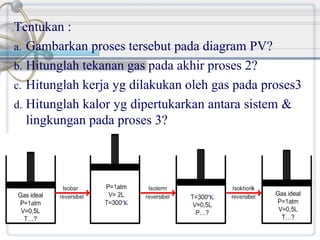
Dokumen ini membahas konsep dasar termodinamika yang mencakup perubahan energi dalam sistem dan interaksi dengan lingkungan. Topik yang dibahas meliputi termodinamika makroskopik dan mikroskopik, hukum-hukum termodinamika, serta aplikasi praktis dalam proses rekayasa kimia. Selain itu, juga dijelaskan berbagai jenis proses, sistem, dan konsep energi terkait seperti entalpi, kerja, dan kalor.