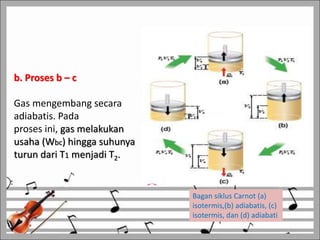
Dokumen tersebut membahas tentang termodinamika, meliputi konsep-konsep seperti usaha sistem terhadap lingkungan, hukum pertama dan kedua termodinamika, proses-proses termodinamika seperti isobarik, isotermik, dan adiabatik, serta siklus Carnot dan efisiensi mesin kalor.