Recommended
PPT
PPT
PPT
PDF
PPT
PDF
PPTX
PPSX
PDF
PDF
กรด เบสและสมดุลไอออน - Ion Equilibrium
PDF
PDF
อิเล็กโทรไลด์และนอนอิเล็กโทรไลด์
PDF
PPT
PDF
PPT
PDF
PPT
พันธะเคมี Part ionic bonds
PDF
PDF
เอกสารประกอบการเรียนรู้ ว40223acids base1
PDF
พันธะเคมี Part ionic bonds
PDF
PDF
PPT
256121 ch2 hc 1-alkane & cycloalkane
PDF
PPT
PDF
PDF
PPT
PPS
More Related Content
PPT
PPT
PPT
PDF
PPT
PDF
PPTX
PPSX
What's hot
PDF
PDF
กรด เบสและสมดุลไอออน - Ion Equilibrium
PDF
PDF
อิเล็กโทรไลด์และนอนอิเล็กโทรไลด์
PDF
PPT
PDF
PPT
PDF
PPT
พันธะเคมี Part ionic bonds
PDF
PDF
เอกสารประกอบการเรียนรู้ ว40223acids base1
PDF
พันธะเคมี Part ionic bonds
PDF
PDF
PPT
256121 ch2 hc 1-alkane & cycloalkane
PDF
PPT
PDF
PDF
Viewers also liked
PPT
PPS
PDF
สารและการจำแนก (Matter and Substance)
PPT
PPT
PDF
การคำนวณพลังงานของปฏิกิริยา
PPT
PPTX
PPT
PPTX
PPTX
PPTX
Sociale innovatie werkt, zegt Henk Volberda.
PPTX
Why do I want to become a teacher?
PPT
PDF
PPT
DOCX
DOC
PPTX
Why do i wantg teacher to become a teacher?
Similar to กรด เบส 1
PDF
PDF
PDF
C5dduududidididididididiidjdssiwiqiiiaai
PPT
PPT
PPT
PDF
PPTX
PDF
PDF
PPSX
PDF
PDF
PPTX
PPTX
ความรู้ทั่วไปเรื่อง สารละลายelectrolyte , Acids - Bases
PPT
PPT
PDF
PPT
PDF
More from Saipanya school
PDF
PDF
PDF
PDF
Atomic model ruth & bohr
PDF
Titration curve & buffer solution
PDF
พันธะโคเวเลนต์ Covalent Bond
PPT
PDF
PDF
PPT
PDF
PDF
PPT
PDF
PDF
PPTX
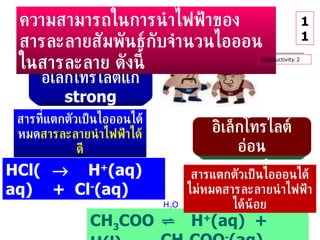
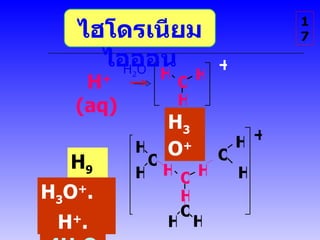
กรด เบส 1 1. 2. จุดประสงค์การเรียนรู้ 1. จำแนกประเภทสารละลายโดยใช้เกณฑ์ที่กำหนดให้ได้ 2. อธิบายเหตุผลที่สารละลายอิเล็กโทรไลต์นำไฟฟ้าได้ 3. สรุปสมบัติบางประการของสารละลายอิเล็กโทรไลต์พร้อมทั้งระบุได้ว่าสารใดเป็นอิเล็กโทรไลต์ 4 อธิบายการเปลี่ยนแปลงของกรดหรือเบสเมื่อละลายในน้ำ พร้อมทั้งระบุชนิดของไอออนที่ทำให้สารละลายแสดงสมบัติของกรดหรือเบสได้ 2 3. 4. HCl NH 4 Cl CH 3 COOH NaCl KNO 3 NaOH KOH NH 3 CH 3 COONa C 2 H 5 OH (NH 2 ) 2 CO C 12 H 22 O 11 กรด เบส กลาง กรด เบส 4 การทดสอบ สารละลายตัวอย่าง ด้วย กระดาษลิตมัส น้ำเงิน แดง 5. 6. สารอิเล็กโทรไลต์ ( Electrolyte) สารที่ละลายน้ำแล้วให้สารละลายที่นำไฟฟ้าได้ สารละลายที่นำไฟฟ้าได้ เรียกว่า สารละลายอิเล็กโทรไลต์ การนำไฟฟ้าเพราะสารอิเล็กโทรไลต์ ละลายน้ำแล้ว แตกตัวเป็น ไอออน ไอออน ใน สารละลายทำหน้าที่นำพาประจุไฟฟ้า เคลื่อนที่ ไอออนที่เคลื่อนไปที่ แคโทด = ไอออนบวก ( + ) cation ไอออนที่เคลื่อนไปที่ แอโนด = ไอออน ลบ ( - ) anion สารละลายอิเล็กโทรไลต์และนอนอิเล็กโทรไลต์ 5 7. 8. 9. 10. 11. HCl(aq) H 2 O H + (aq) + Cl - (aq) CH 3 COOH(l) H 2 O ⇌ H + (aq) + CH 3 COO - (aq) ความสามารถในการนำไฟฟ้าของสารละลายสัมพันธ์กับจำนวนไอออนในสารละลาย ดังนี้ สารที่แตกตัวเป็นไอออนได้หมด สารละลายนำไฟฟ้าได้ดี สารแตกตัวเป็นไอออนได้ไม่หมด สารละลายนำไฟฟ้าได้น้อย Conductivity 2 11 อิเล็กโทรไลต์แก่ strong electrolyte อิเล็กโทรไลต์อ่อน weak electrolyte 12. 13. 14. HCl NH 4 Cl CH 3 COOH NaOH KOH NH 3 CH 3 COONa 14 15. 16. ไฮโดรเนียมไอออน เกิดจาก กรด ให้ H + แก่น้ำ ไฮโดรเนียมไอออน ไม่ได้อยู่เป็นไอออนเดี่ยว แต่จะถูก hydrate ( น้ำล้อมรอบ ) เสมอ : อาจอยู่ในรูปของ ในสารละลายกรดทั้งสองชนิดมีไอออนที่เหมือนกัน คือ H 3 O + ( ไฮโดรเนียมไอออน ) 16 เพื่อความสะดวก ใช้ H + หรือ H 3 O + H 9 O 4 + 17. H 2 O H + (aq) H 3 O + H 9 O 4 + H 3 O + . 3H 2 O H + . 4H 2 O 17 + H H H O H H H O O + H H H O H H H O ไฮโดรเนียมไอออน 18. 19. 20. OH - สรุป ไอออน ในสารละลายกรดและสารละลายเบส ในสารละลายกรดทุกชนิด มีไฮโดรเนียมไอออน ในสารละลายเบสทุกชนิดมีไฮดรอกไซด์ไอออน H 3 O + 20