Recommended
PPT
PPT
PDF
PPT
PDF
เอกสารประกอบการเรียนรู้ ว40223acids base1
PDF
อิเล็กโทรไลด์และนอนอิเล็กโทรไลด์
PDF
PPT
PDF
PDF
PDF
PDF
PPT
PPT
PPTX
PDF
PPT
PDF
กรด เบสและสมดุลไอออน - Ion Equilibrium
PPT
PDF
PPT
PPT
PDF
วิชาเคมี มัธยมปลาย เรื่องปฏิกริยากรดเบส
PDF
PDF
PDF
สื่อประกอบการสอนวิชาเคมีเพิ่มเติม3 ว30223 โดยครูนิติมา รุจิเรขาสุวรรณ
PDF
วิชาเคมี มัธยมปลาย เรื่องปฏิกริยาไฟฟ้าเคมี
PPTX
Non-aqueous acid base titrimetry
PDF
10 non aqueous-titrations
PPTX
Non Aqueous Acid Base Titration
More Related Content
PPT
PPT
PDF
PPT
PDF
เอกสารประกอบการเรียนรู้ ว40223acids base1
PDF
อิเล็กโทรไลด์และนอนอิเล็กโทรไลด์
PDF
PPT
What's hot
PDF
PDF
PDF
PDF
PPT
PPT
PPTX
PDF
PPT
PDF
กรด เบสและสมดุลไอออน - Ion Equilibrium
PPT
PDF
PPT
PPT
PDF
วิชาเคมี มัธยมปลาย เรื่องปฏิกริยากรดเบส
PDF
PDF
PDF
สื่อประกอบการสอนวิชาเคมีเพิ่มเติม3 ว30223 โดยครูนิติมา รุจิเรขาสุวรรณ
PDF
วิชาเคมี มัธยมปลาย เรื่องปฏิกริยาไฟฟ้าเคมี
Viewers also liked
PPTX
Non-aqueous acid base titrimetry
PDF
10 non aqueous-titrations
PPTX
Non Aqueous Acid Base Titration
PDF
P pt wpp สุราษฎร์ตอนที่3 หลากกลเม็ดการสอนวิทย์
PPTX
non aqueous titration, pharmaceutical and cosmetic analysis,Pca seminar
PPTX
PPT
Similar to Acid base1
PPT
PDF
PPTX
PDF
C5dduududidididididididiidjdssiwiqiiiaai
PPTX
PPT
PPT
PDF
PPSX
PDF
PPT
PDF
PPT
PDF
PDF
PPT
สมบัติของธาตุและสารประกอบ2
PDF
Slideที่ 8 ไอออนในสารละลายกรด เบส(เผยแพร่)
PPSX
PDF
PPT
Acid base1 1. 2. 3. 2) อิเล็กโตรไลตออน
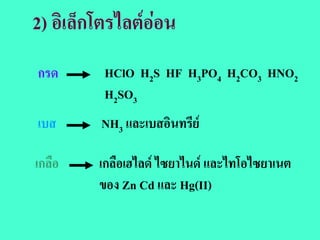
กรด HClO H2S HF H3PO4 H2CO3 HNO2
H2SO3
เบส NH3 และเบสอินทรีย
เกลือ เกลือเฮไลด ไซยาไนด และไทโอไซยาเนต
ของ Zn Cd และ Hg(II)
4. 5. 6. เบส คือ สารที่ ละลายน้ํา แลวแตกตัวให
OH - เชน
NaOH Na + + OH-
Ba(OH)2 Ba 2+ + 2OH-
Ca(OH)2 Ca 2+ + 2OH-
7. ความแรงของกรดและเบส
กรดแก คือ กรดที่แตกตัวให H + มาก
กรดออน คือ กรดที่แตกตัวให H + นอย
เบสแก คือ เบสที่แตกตัวให OH - มาก
เบสออน คือ เบสที่แตกตัวให OH - นอย
8. 9. H ++ OH - H2O(l)
HCl + NaOH NaCl + H2O
กรด + เบส เกลือ + น้ํา
10. 11. 12. 13. HCl(aq)+H2O(l) H3O+(aq) +Cl-(aq)
กรด1 เบส2 กรด2 เบส1
โดย
HCl และ Cl- เปน คูกรด-เบส คูที่ 1(conjugate acid-base)
H3O+ และ H2O เปน คูกรด-เบส คูที่ 2 (conjugate acid-base)
และ
Cl- เปนคูเบส (conjugate base) ของกรด HCl
HCl เปนคูกรด (conjugate acid) ของ Cl-
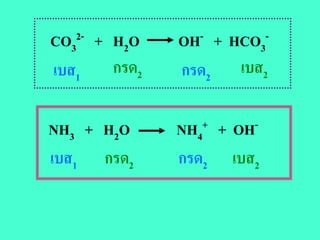
14. CO32- + H2O OH- + HCO3-
เบส1 กรด2 กรด2 เบส2
NH3 + H2O NH4+ + OH-
เบส1 กรด2 กรด2 เบส2
15. 16. 17. ขอสังเกต
1. สําหรับคูกรด-เบสคูหนึ่ง ถากรดเปนกรดแก คูเบสจะเปน
เบสออน เชน HCl เปน กรดแก Cl- เปน เบสออน
NH3 เปน เบสออน NH4+ เปน กรดแก
2. กรดหรือเบสอาจเปนโมเลกุลหรือไอออนก็ได
3. โมเลกุลของน้ําอาจเปนฝายใหหรือรับ H+ ก็ได
นั่นคือ น้ําเปนแอมฟโปรติกหรือแอมโฟเทอริก
18. คาคงที่ของสมดุล
สมดุลของกรด
ถามี กรด HA ชนิดหนึ่ง ซึ่งมีการแตกตัวดังสมการ
HA(aq)+H2O(l) H3O+(aq)+ A-(aq)
จะมีคาสมดุลดังนี้
Ka = [H3O+][A-]
[HA]
เมื่อ Ka เปนคาคงทีของการแตกตัวของกรด
่
19. สมดุลของเบส
ถามีเบส B ชนิดหนึ่ง ซึ่งมีการแตกตัวดังสมการ
B(aq) + H2O(l) BH+(aq) + OH-(aq)
จะมีคาสมดุลดังนี้
Kb = [BH+][OH-]
[B]
เมื่อ Kb เปนคาคงที่ของการแตกตัวของเบส
20. 21. ตัวอยางที่ 2 สารตอไปนี้ สารใดเปน กรดหรือเบสตามนิยาม
บรอนสเตด-เลารี
ก. HI ข. HNO2 ค. NH4+ ง. NH2- จ. HCO3-
ก. HI เปน กรด
ข. HNO2 เปน กรด
ค. NH4+ เปน กรด
ง. NH2- เปน เบส
จ. HCO3- เปน กรดและเบส
22. 1.3 นิยามของลิวอิส
กรด คือ สารที่รับคู e- จากเบสได แลวเกิดพันธะโคเวเลนต
เบส คือ สารที่ใหคู e- ในการเกิดพันธะโคเวเลนต
H .. ..
+ + :O-H - ..
H-O-H
..
H F H F
H-N: + B-F H-N B-F
H F H F
เบส กรด
23. ส.ป.ก. ที่ธาตุมี V. e- < 8 หรือมีออรบิตอลวาง เชน BF3
AlCl3 จัดเปน กรดลิวอิส และเรียกธาตุนั้น วา อิเล็กโตรไฟล
(Electrophile)
ส.ป.ก.หรือไอออนที่มีคู e- โดดเดยว จัดเปน เบสลิวอิส
ี่
และเรียกอะตอมนั้นวา donor atom หรือนิวคลีโอไฟล
(Nucleophile) เชน O ใน OH-
N ใน NH3
24. 25. 26. 1.4 นิยามระบบตวทําละลาย
ั
กรด คือ สารที่ใหไอออนบวกของตัวทําละลาย (ไอออนกรด)
เบส คือ สารที่ใหไอออนลบของตัวทําละลาย (ไอออนเบส)
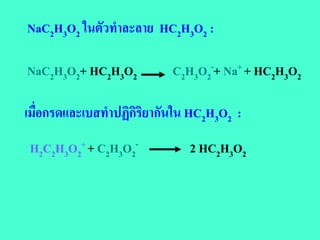
กรด HCl ในตัวทําละลาย HC2H3O2:
HCl + HC2H3O2 H2C2H3O2+ + Cl-
กรด ตัวทําละลาย ไอออนกรดของ
ตัวทําละลาย
27. 28. 29. 30. กรดออกซี (H-O-Z)
ความแรง ENZ
ถาเปนกรดออกซีของอโลหะตัวเดียวกัน :
ความแรง จํานวน O-atom Oxidation number
HClO<HClO2<HClO3<HClO4
31. เบส
- คาบเดียวกัน
ความแรง EN
เชน NH3 > H2O > HF
NH2- > OH-> F-
ความแรง จํานวนประจุ
เชน N3- > O2- > F-
N3- > NH2- > NH2- > NH3
32. 33.







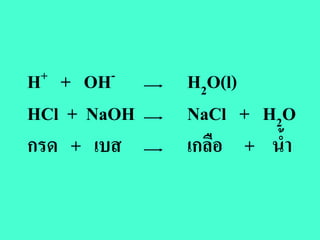







![คาคงที่ของสมดุล
สมดุลของกรด
ถามี กรด HA ชนิดหนึ่ง ซึ่งมีการแตกตัวดังสมการ
HA(aq)+H2O(l) H3O+(aq)+ A-(aq)
จะมีคาสมดุลดังนี้
Ka = [H3O+][A-]
[HA]
เมื่อ Ka เปนคาคงทีของการแตกตัวของกรด
่](https://image.slidesharecdn.com/acid-base1-130310012638-phpapp01/85/Acid-base1-18-320.jpg)
![ สมดุลของเบส
ถามีเบส B ชนิดหนึ่ง ซึ่งมีการแตกตัวดังสมการ
B(aq) + H2O(l) BH+(aq) + OH-(aq)
จะมีคาสมดุลดังนี้
Kb = [BH+][OH-]
[B]
เมื่อ Kb เปนคาคงที่ของการแตกตัวของเบส](https://image.slidesharecdn.com/acid-base1-130310012638-phpapp01/85/Acid-base1-19-320.jpg)