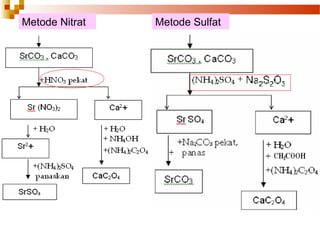
Dokumen tersebut menjelaskan prosedur pemisahan dan identifikasi kation Golongan IV, yaitu Ba2+, Sr2+, dan Ca2+ melalui metode pemisahan kation dengan reagen NH4Cl, NH4OH, dan (NH4)2CO3. Kation-kation tersebut akan diendapkan sebagai karbonatnya dan kemudian dipisahkan menggunakan metode sulfat atau nitrat.


![
Ques.1. Mengapa filtrat Gol. III perlu diuapkan sampai hampir kering ?
Ans. :
1. Untuk mengeluarkan H2S, mencegah oksidasi S2- menjadi SO42- dan mencegah
pengendapan Ba2+ & Sr2+ dengan SO42- [ CaSO4 Ksp tinggi maka membutuhkan
konsentrasi ion SO42- yang tinggi untuk mengendapkannya]
2. Dengan penambahan HNO3 pada fitrat maka ion NH4+ menguap sebagai N2O.
NH4+ + HNO3 N2O + 2H2O + H+
Ques.2. Mengapa diperlukan penambahan NH4+ yang sesuai?
Ans. : Karena kelebihan NH4+ akan mengurangi konsentrasi ion karbonat.
NH4+ + CO32-
NH3 + HCO3-
N.B. Larutan sedikit basa. Jika suasana asam karbonat akan berubah menjadi
HCO3- yang larut
CO3- + H+ HCO3-
Ques.3. Mengapa digunakan NH4Cl ?
Ans. :
1- Dengan adanya ion sejenis sehingga mengurangi konsentrasi ion OH- dan CO32sehingga mencegah pengendapan Mg sebagai Mg(OH)2 atau MgCO3
](https://image.slidesharecdn.com/pemisahankationgol-140104183943-phpapp01/85/Pemisahan-kation-gol-iv-3-320.jpg)

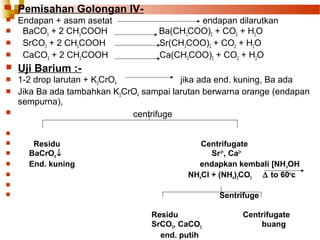


![
Uji Kalsium :-
1- Larutan + NH4OH + ammonium oksalat
end. Putih CaC2O4
C2O4(NH4)2 + Ca2+
C2O4Ca ↓ + 2NH4Cl
end. putih
2- Larutan + NH4Cl + Kalium ferosianida
end. kuning
Ca2+ + NH4+ + K+ + [Fe(CN)6]4-
CaNH4K[Fe(CN)6]↓
Uji NyalaSr2+
SrSO4 panaskan pada api reduksi
Sr S + HCl
SrCl2 menguap dalam nyala merah krimson
Ca2+
Ca C2O4 + HCl
Ca Cl2 menguap dalam nyala merah bata.](https://image.slidesharecdn.com/pemisahankationgol-140104183943-phpapp01/85/Pemisahan-kation-gol-iv-9-320.jpg)
![
Uji Kalsium :-
1- Larutan + NH4OH + ammonium oksalat
end. Putih CaC2O4
C2O4(NH4)2 + Ca2+
C2O4Ca ↓ + 2NH4Cl
end. putih
2- Larutan + NH4Cl + Kalium ferosianida
end. kuning
Ca2+ + NH4+ + K+ + [Fe(CN)6]4-
CaNH4K[Fe(CN)6]↓
Uji NyalaSr2+
SrSO4 panaskan pada api reduksi
Sr S + HCl
SrCl2 menguap dalam nyala merah krimson
Ca2+
Ca C2O4 + HCl
Ca Cl2 menguap dalam nyala merah bata.](https://image.slidesharecdn.com/pemisahankationgol-140104183943-phpapp01/85/Pemisahan-kation-gol-iv-10-320.jpg)