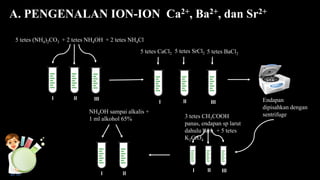
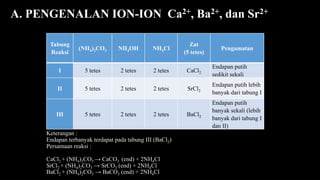
Dokumen ini membahas pengenalan dan pembeda ion-ion Ca2+, Ba2+, dan Sr2+ serta ion-ion Fe3+, Mn2+, Cr3+, dan Al3+ melalui praktikum kimia. Melalui serangkaian reaksi dengan larutan dan endapan, diketahui bahwa Ba2+ menghasilkan endapan terbanyak diikuti Sr2+ dan Ca2+. Selain itu, reaksi spesifik digunakan untuk membedakan sifat masing-masing ion berdasarkan warna dan jenis endapan yang terbentuk.






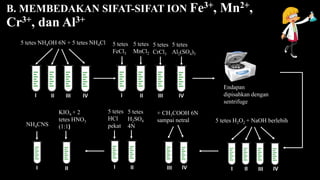



![B. MEMBEDAKAN SIFAT-SIFAT ION
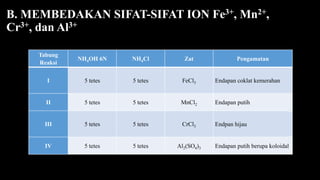
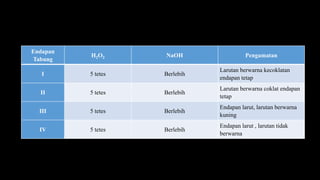
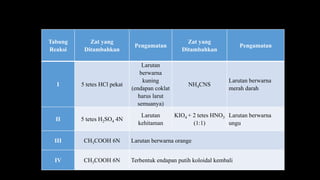
Fe3+, Mn2+, Cr3+, dan Al3+
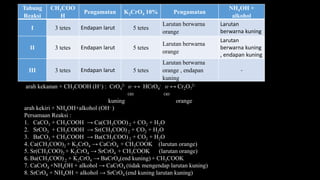
• Persamaan reaksi ion Fe3+ :
FeCl3 + 3NH4OH → Fe(OH)3 (end)+ 3NH4Cl
Fe(OH)3 + 3HCl → FeCl3 + 3H2O
Fe3+ + 6SCN- → [Fe(SCN)6]3-
merah darah
• Persamaa reaksi ion Mn2+ :
MnCl2 + 2NH4OH → Mn(OH)2 (end)+ 2NH4Cl
Mn(OH)2 + H2O2 → MnO(OH)2 + H2O
2MnO2 + 2H2SO4 → 2MnSO4 + 2H2O + O2
2Mn2+ + 5IO4
- + 3H2O → 2MnO4
- + 5IO3
- + 6H+
ungu](https://image.slidesharecdn.com/pengenalanbeberapaunsur-231011013040-e82cfac6/85/PENGENALAN-BEBERAPA-UNSUR-17-320.jpg)




