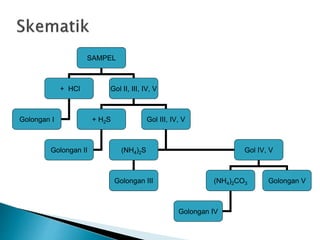
Dokumen tersebut membahas tentang tiga jenis analisis kimia berdasarkan kuantitas zat dan volume yang digunakan, yaitu analisis makro, semimikro, dan mikro. Dokumen juga membahas beberapa keuntungan penggunaan analisis semimikro dan mikro seperti penggunaan zat dan volume yang lebih sedikit serta kecepatan dan ketajaman analisis yang lebih tinggi.







![Larutan jenuh merupakan suatu sistem
kesetimbangan, contoh :
AgCl Ag+ + Cl-
Ini merupakan kesetimbangan heterogen karena
AgCl dalam bentuk padat, sedangkan Ag+ dan
Cl- dalam bentuk larutan
Hasil kali kelarutan :
Ks = [Ag+] [Cl-]
Bila Ks terlewati artinya kesetimbangan bergeser
kearah kanan, akan terbentuk endapan AgCl](https://image.slidesharecdn.com/analisiskualitatifkationdananionsic-230220092041-95fbe603/85/ANALISIS_KUALITATIF_KATION_DAN_ANION_SIc-ppt-8-320.jpg)

![ Fenomena penting yang sering terjadi “bila
kompleks terbentuk adalah kenaikan
kelarutan”
Banyak endapan bisa melarut karena
pembentukan kompleks
Contoh :
◦ AgCN(s) + CN- [Ag(CN)2]-
Penambangan CN berlebih menyebabkan endapan
berubah menjadi ion yang larut](https://image.slidesharecdn.com/analisiskualitatifkationdananionsic-230220092041-95fbe603/85/ANALISIS_KUALITATIF_KATION_DAN_ANION_SIc-ppt-10-320.jpg)