Dokumen tersebut memberikan penjelasan tentang analisis kation secara kualitatif melalui pemisahan golongan dan tes spesifik. Terdapat lima langkah utama yaitu analisis pendahuluan, penentuan golongan, pemisahan golongan, dan tes spesifik untuk mengidentifikasi kation. Dokumen ini juga menjelaskan alat, bahan, dan prosedur yang digunakan dalam analisis kation secara sistematis.


![5
E. Analisis Kation dengan Reaksi Spesifik
Tes spesifik untuk mengetahui adanya kation tertentu dalam suatu larutan.
a. Ag+
Ag+ + Cl- → AgCl(s) ↓ putih
Ag+ + OH- → AgOH(s) ↓ hitam cokelat
AgOH + 2 NH3 → (Ag(NH3)2)+ ( larutan) larut dalam amoniak berlebih
b. Pb2+
Pb2+ + CrO4
2- → PbCr4(s) ↓ putih
Pb2+ + SO2- → PbSO4(s) ↓ putih
Pb2+ + OH- → Pb(OH)2(s) ↓ putih tidak larut dalam amoniak berlebih
c. Hg2+
Hg2+ + OH- → Hg2O ↓ kuning + H2O
Hg2+ + 2 I- → HgI2 ↓ merah
d. Cu2+
2 Cu2+ + SO4
Analisis kation 01/1KB
2- + 2 NH3 + 2 H2O → Cu(OH)2.CuSO4↓ + 2 NH4+
Cu2+ + 2 OH- → Cu(OH)2 ↓ biru
Cu(OH)2↓ → CuO↓ hitam + H2O
e. Sn2+
Sn2+ + Hg2Cl2 → Hg2Cl2↓ putih + Sn4+ + 2 Cl-
Jika ditambah Sn2+ berlebih :
Sn2+ + Hg2Cl2 → 2 Hg↓ abu-abu + Sn4+ + 2 Cl-f.
Fe2+
Fe2+ + 2OH- → Fe(OH)2 ↓ putih
4 Fe(OH)2 + H2O + O2 → 4 Fe(OH)3 ↓ coklat merah
Fe2+ + [Fe(Cn)6]3- → Fe3+ + [Fe(Cn)6]4-
4 Fe3+ + 3[Fe(Cn)6]4- → Fe4[Fe(Cn)6]3 ↓ biru tumbull](https://image.slidesharecdn.com/analisiskation-141204021647-conversion-gate02/85/Analisis-kation-5-320.jpg)
![Fe3+ + 3SCN → Fe(SCN)3 merah tua
Fe3+ + [Fe(Cn)6]3- → Fe[Fe(Cn)6] coklat
Dengan menambahkan H2O2 atau sedikit larutan timah II klorida menghasilkan
endapan biru prusia.
6
g. Fe3+
h. Co2+
Co2+ + 4SCN- → [Co(SCN)4]2- biru
i. Mn2+
Mn2+ + 5 NaBiO3 + 14H+ → 2 MnO4+ + 5 Bi3+ + 5 Na+ + 7 H2O
Menghasilkan warna ungu dari permanganat
j. Ni2+
k. Al3+
Al3+ + 3 CH3COO- + H2O → Al(OH)2CH3COO↓ + 2CH3COOH
Al3+ + 3OH- → Al(OH)3↓ putih
l. Ba2+
Ba2+ + SO4
2- → BaSO4↓ putih
Ba2+ + CrO4
2- → BaCrO4↓ kuning
m. Ca2+
Ca2+ + SO4
2- → CaSO4↓ putih
Ca2+ + CrO4
2- → tidak terbentuk endapan
n. NH4+
NH4+ + OH- → NH3↑ + H2O
Timbul bau, kertas lakmus merah berubah menjadi biru
Analisis kation 01/1KB](https://image.slidesharecdn.com/analisiskation-141204021647-conversion-gate02/85/Analisis-kation-6-320.jpg)
![7
o. Mg2+
Mg2+ + NH3
+ + HPO4
Analisis kation 01/1KB
2- → Mg(NH4)PO4↓ kristalin putih
p. K+
3 K+ + [Co(NO2)6]3- → K3[Co(NO2)6] ↓ kuning
q. Na+
Na+ + Mg2+ 3UO2+ + 9 CH3COO- → NaMg(UO2)3(CH3COO)9↓ Kristalin kuning
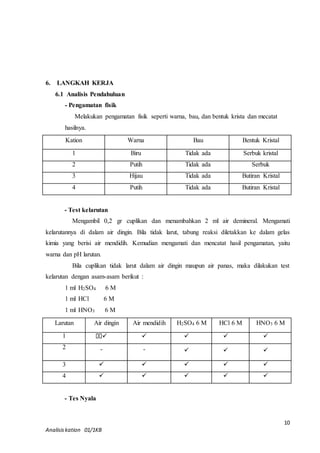
Test nyala](https://image.slidesharecdn.com/analisiskation-141204021647-conversion-gate02/85/Analisis-kation-7-320.jpg)