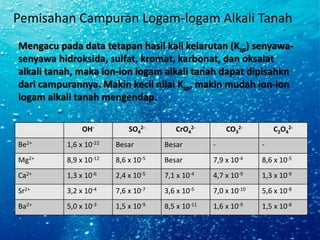
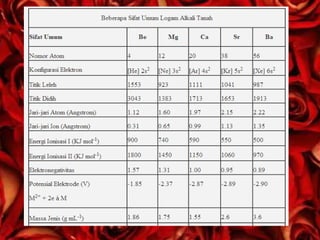
Dokumen ini menjelaskan mengenai logam alkali tanah yang terdiri dari berilium, magnesium, kalsium, stronsium, barium, dan radium, serta karakteristik dan reaksi kimia mereka. Setiap unsur memiliki aplikasi yang berbeda, seperti dalam paduan logam, pewarna kembang api, dan bahan bangunan. Selain itu, dijelaskan juga tentang kesadahan air dan cara menghilangkannya.







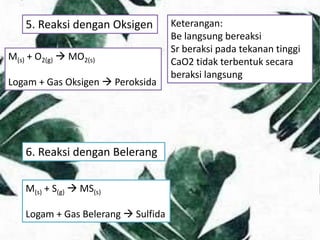

![9. Reaksi dengan Asam
M(s) + SH+
(aq) M2+
(aq) + H2(g)
Logam + Asam Ion Logam + Gas Hidrogen
10. Reaksi dengan Basa
Be(s) + 2OH-
(aq) + 2H2O(l) [Be(OH)4]2-
(aq) + H2(g)
Logam Berilium + Ion Hidroksida + Air Ion Tetrahidroksoberilat + Gas Hidrogen
Keterangan:
Hanya dengan basa kuat](https://image.slidesharecdn.com/kimia-181126153115/85/Kimia-Logam-Alkali-Tanah-11-320.jpg)