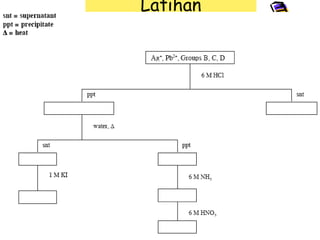
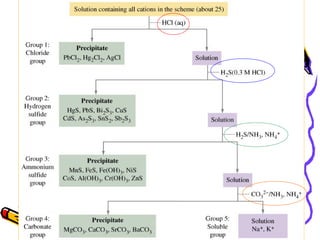
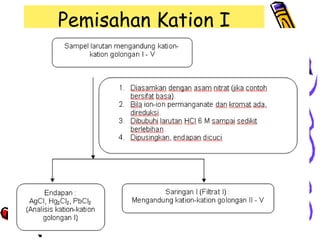
Dokumen ini membahas tentang pemisahan kation gol. I dengan menggunakan metode pengendapan, di mana berbagai reaksi kimia digunakan untuk memisahkan kation seperti Pb²⁺, Ag⁺, dan Hg₂²⁺. Proses pemisahan melibatkan penambahan reagen, sentrifugasi, dan langkah-langkah konfirmasi identifikasi kation yang terpisah.




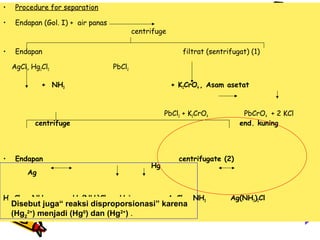
![•
•
•
•
•
•
•
•
N.B.
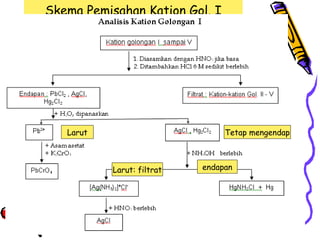
Ksp Pb Cl2 tinggi, maka tidak mengendap sempurna.
Pb Cl2
Ksp = 1.6 x 10-6
Ag Cl
Ksp = 1.0 x 10-10
Hg2 Cl2 Ksp = 1.0 x 10-18
Urutan Pengendapan Hg2+2 > Ag+ > Pb+2
Dalam HCl berlebih, endapan Pb Cl2 membentuk
kompleks yang larut, dan masuk ke kation Gol II (i.e
PbCl2 larut dalam Cl- berlebih)
Pb+2 + ClPbCl2
•
[PbCl3]- + Cl[PbCl4]2• PbCl2 + ClSoluble complex
•](https://image.slidesharecdn.com/pemisahankationgol-140101041600-phpapp02/85/Pemisahan-kation-gol-i-8-320.jpg)
![•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
Konfirmasi identifikasi (Pb2+):1- Pendinginan filtrat/sentrifugat(1)
end. Putih PbCl2
2- Sentrifugat(1)+ KI
end. kuning Pb I2 (larut dalam KI berlebih)
PbCl2 + KI
Pb I2
end. kuning
PbI2 + I- berlebih
[PbI4]2kompleks larut
3- Sentrifugat + asam asetat + K2CrO4
End. Kuning PbCrO4
PbCl2 + K2CrO4
PbCrO4 + 2 KCl
Ques.:
end. kuning
Mengapa pengasaman dengan asam asetat bukan dengan asam mineral
kuat ?
Ans : Karena dalam asam kuat:
2CrO42- +2 H+
Cr2O72- + H2O
i.e. terbentuk dikromat dan Pb Cr2O7 yang larut
Dengan suasana alkalin end. Kuning menjadi merah
2 PbCrO4 + H2O
Pb2CrO5 + H2CrO4
end. merah](https://image.slidesharecdn.com/pemisahankationgol-140101041600-phpapp02/85/Pemisahan-kation-gol-i-10-320.jpg)
![• Konfirmasi Identifikasi (Ag+):
.
• Filtrat diasamkan dengan HNO3
AgCl + NH4NO3
• [Ag(NH3)2]Cl + 2 HNO3
•
end. putih
• Kompleks [Ag(NH3)2]Cl memiliki Kstab,yang tinggi sehingga sulit
terdisosiasi
• Penambahan asam meningkatkan disosiasi komples
[Ag(NH3)2]Cl menghasilkan kation Ag+ sehingga Ksp AgCl (1010
) terlampaui, terbentuk endapan putih AgCl.
•
Ag++ 2 NH3
• [Ag(NH3)2]+
NH3 + H+
NH4+
•
•
push the reaction forward forming more Ag+
• Penambahan H+ mengubah NH3 menjadi NH4+ sehingga
meningkatkan disosiasi kompleks perak amina](https://image.slidesharecdn.com/pemisahankationgol-140101041600-phpapp02/85/Pemisahan-kation-gol-i-11-320.jpg)