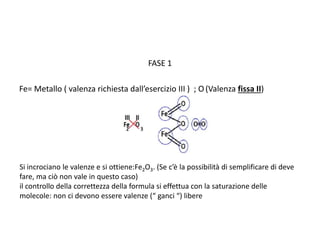
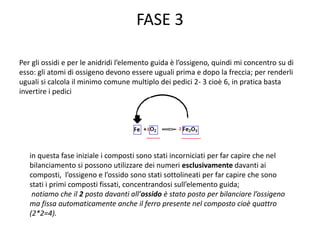
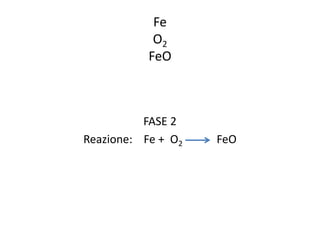
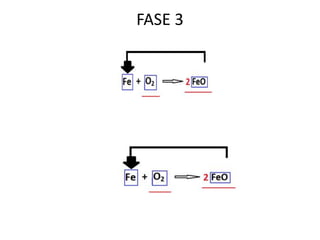
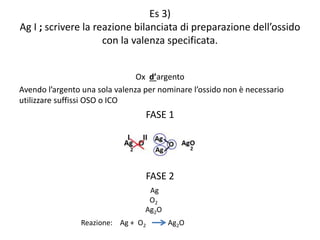
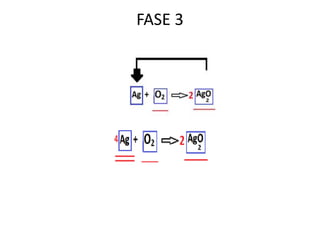
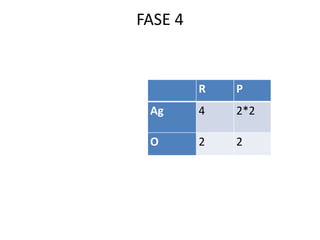
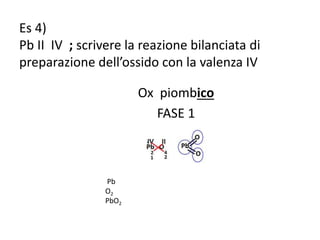
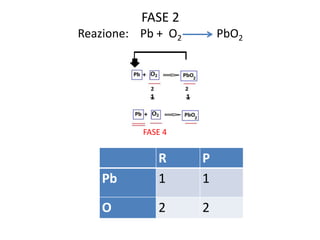
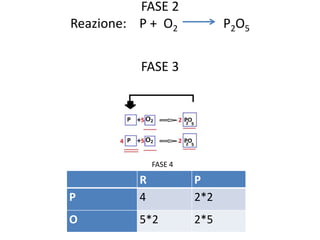
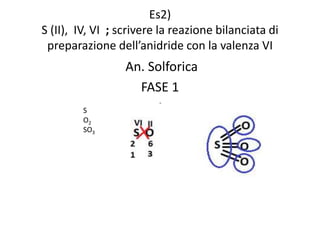
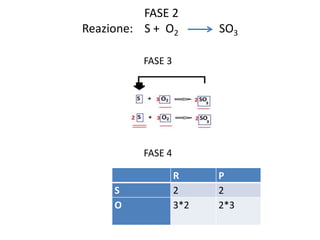
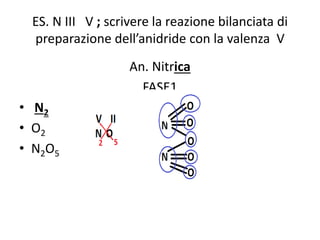
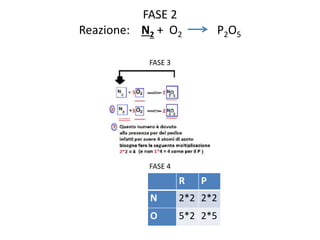
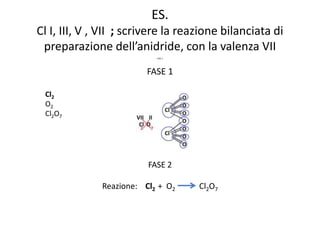
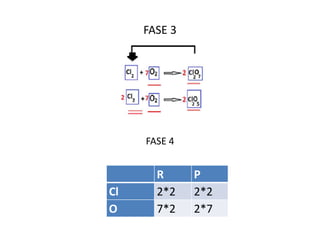
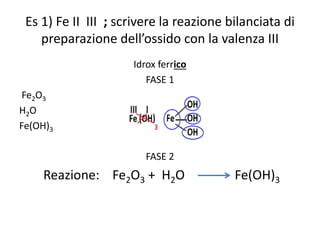
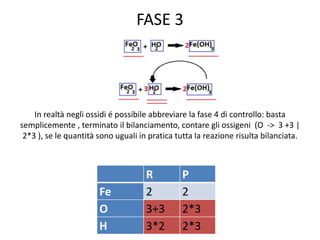
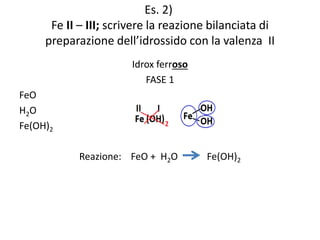
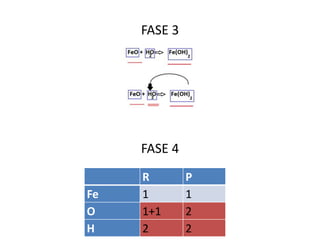
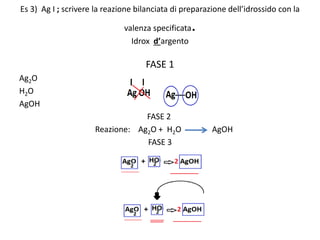
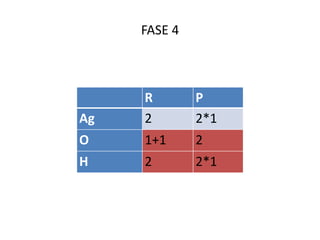
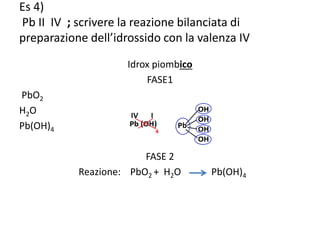
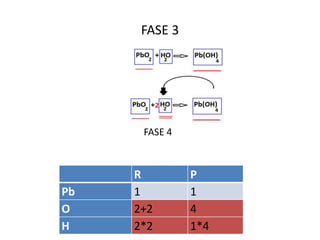
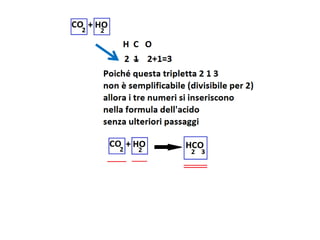
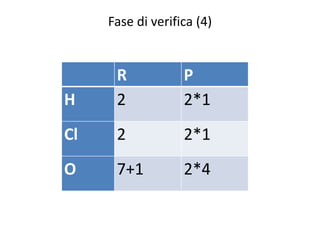
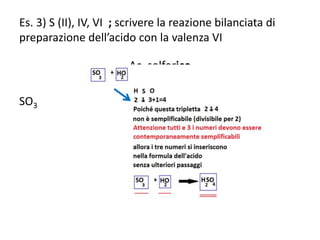
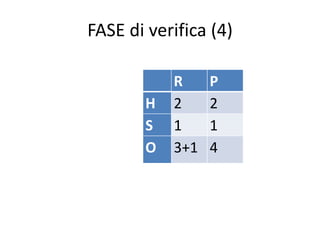
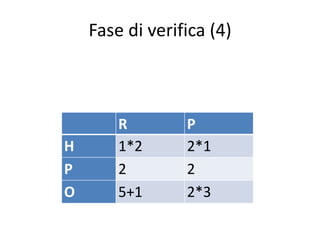
Il documento tratta della nomenclatura e sintesi dei composti inorganici, descrivendo le fasi di preparazione e bilanciamento delle reazioni per ossidi, anidridi, idrossidi e acidi. Vengono forniti esempi di reazioni e si evidenziano le complicazioni legate alle valenze e nomenclatura di alcuni elementi. Infine, viene chiarito il procedimento da seguire per scrivere le formule e bilanciare le reazioni chimiche.