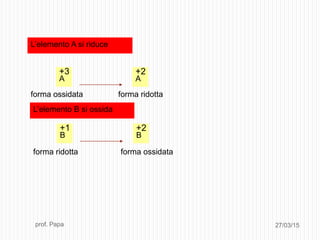
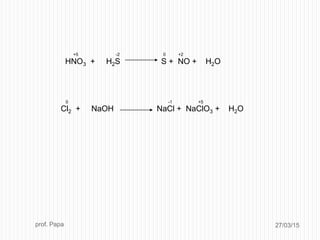
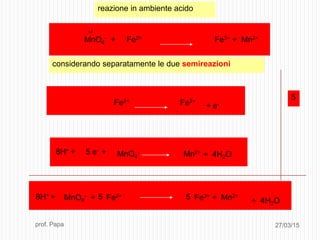
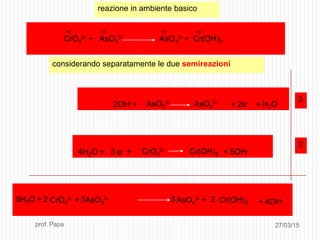
Il documento tratta le reazioni di ossido-riduzione (redox), spiegando le definizioni di ossidazione e riduzione e il loro riconoscimento. Viene descritto il processo di bilanciamento delle reazioni redox attraverso la scrittura di semireazioni e il bilanciamento delle masse e delle cariche elettriche. Inoltre, il documento include esempi pratici e domande per valutare la comprensione degli argomenti affrontati.