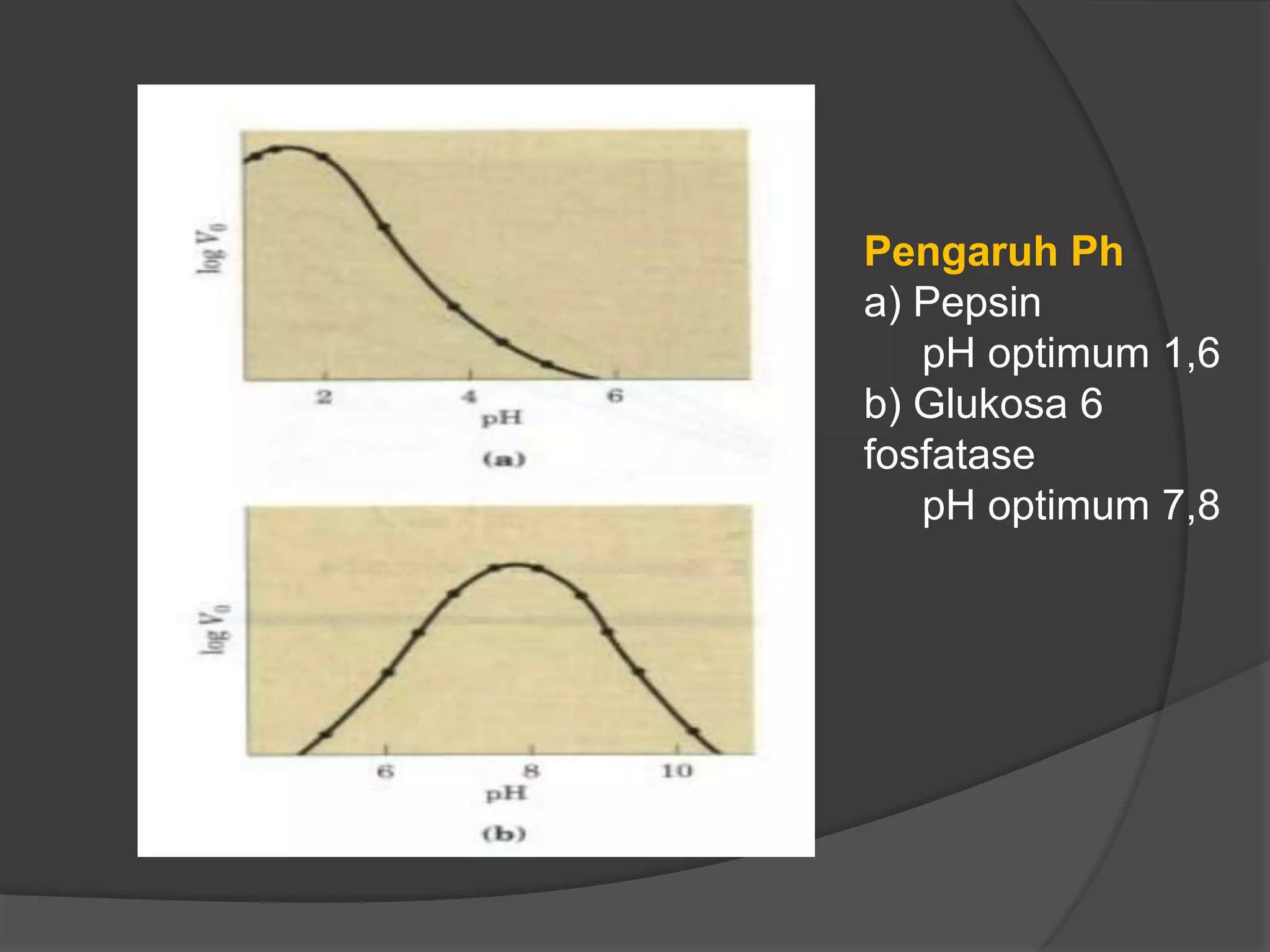
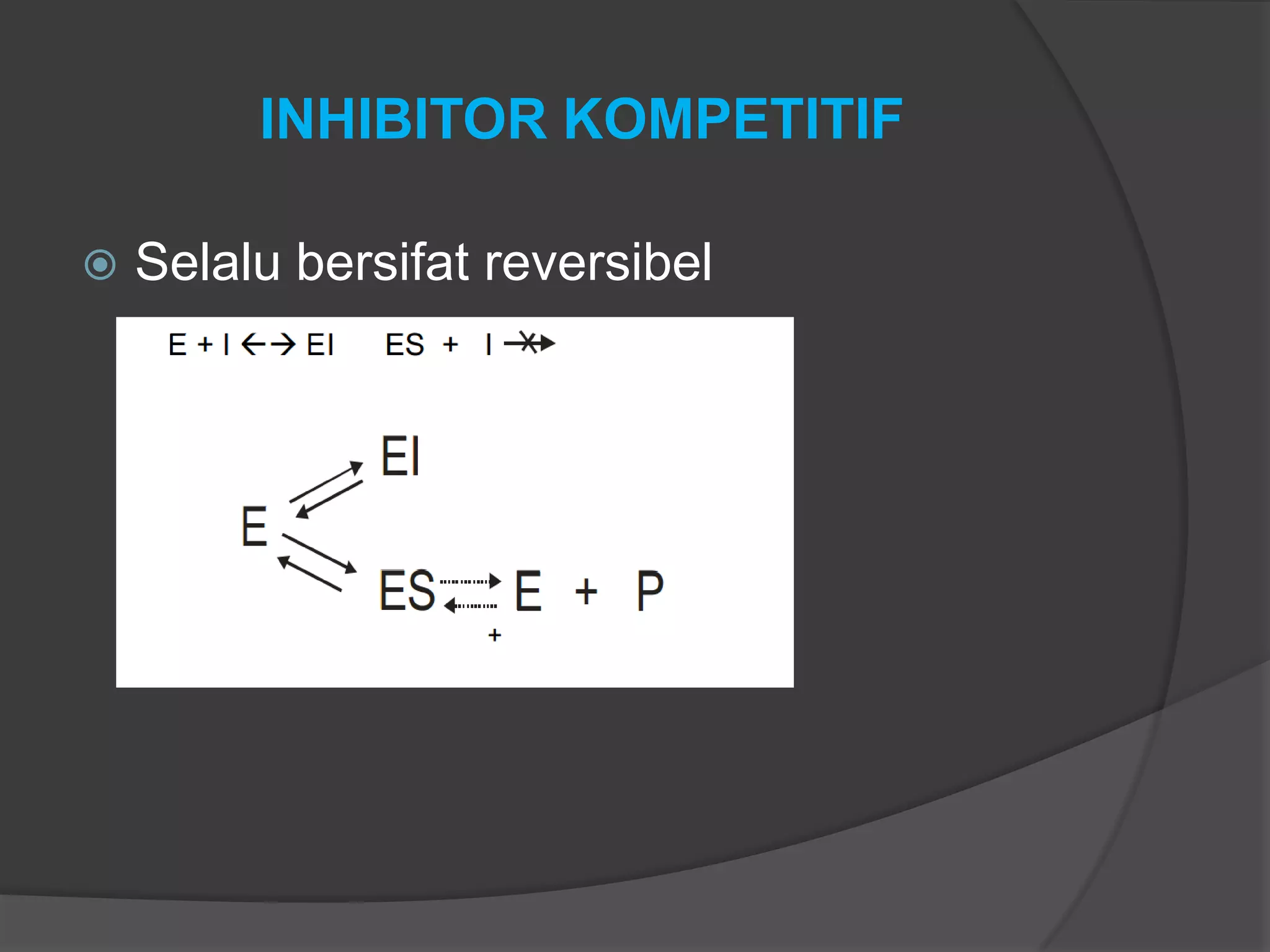
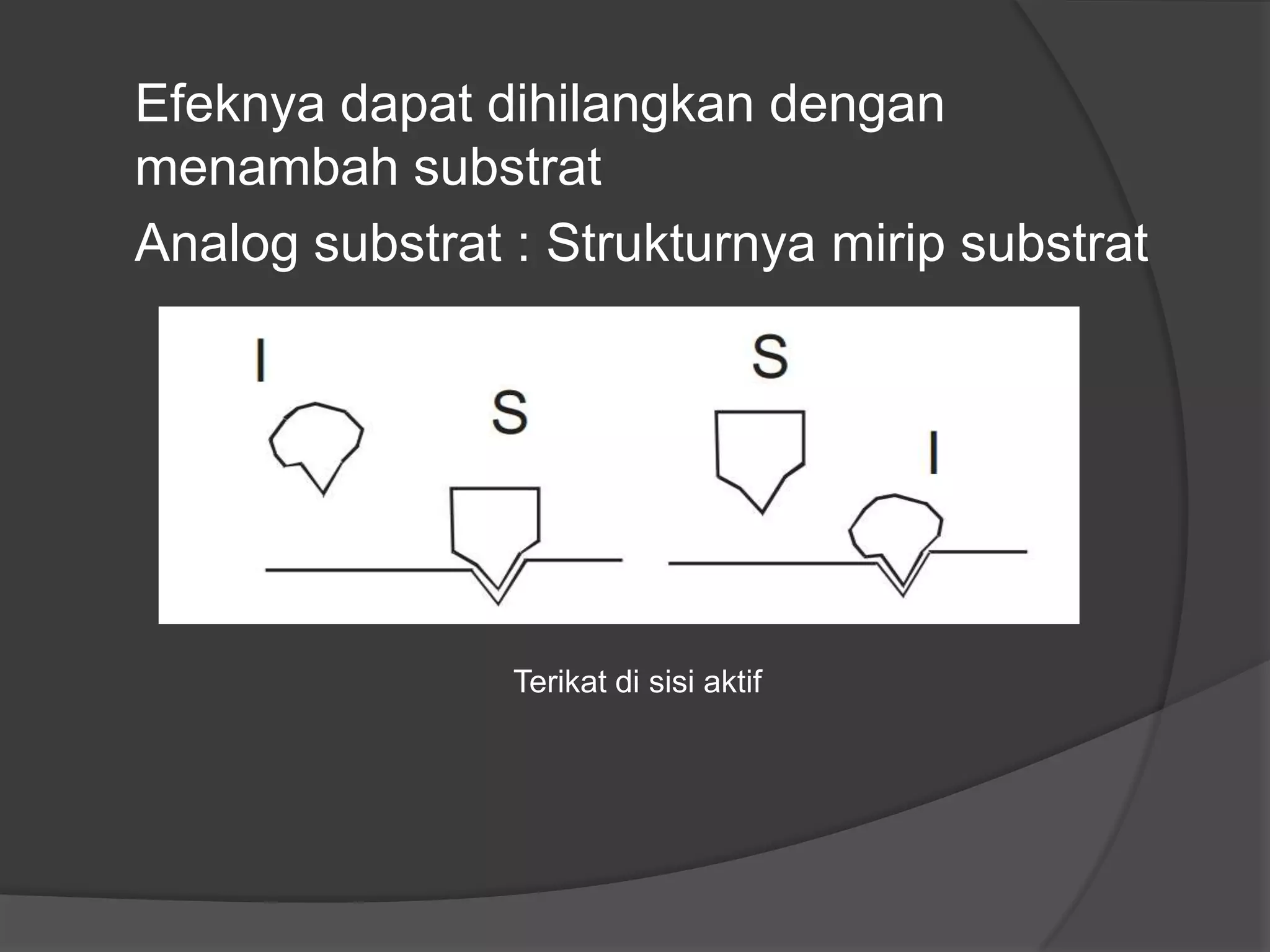
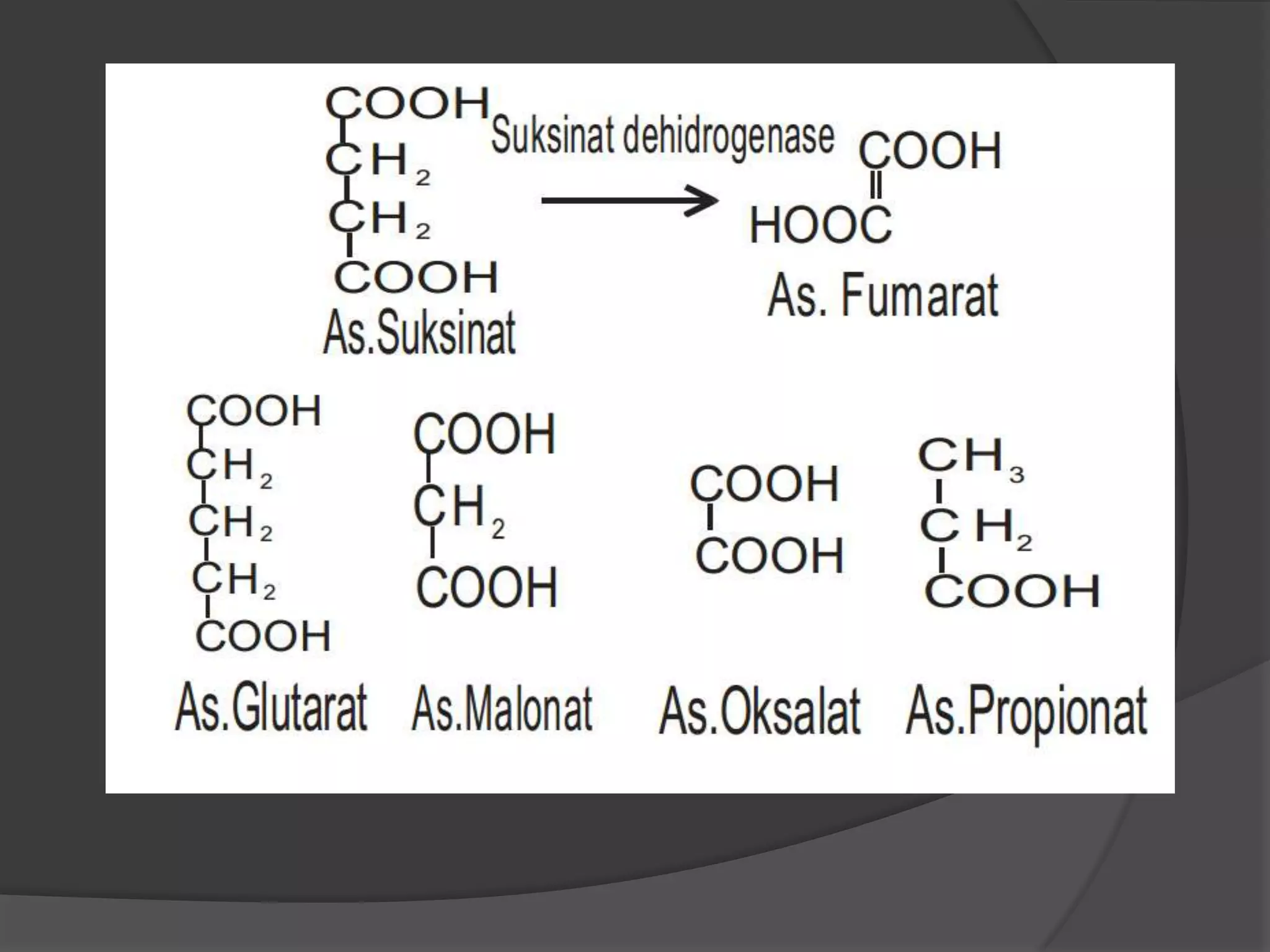
Dokumen tersebut membahas tentang kinetika enzim, termasuk anggota kelompok peneliti, alasan mempelajari kinetika enzim, cara memperoleh data kinetika enzim, parameter kinetika seperti Km dan Vmaks, pengaruh faktor seperti substrat, temperatur, dan inhibitor terhadap aktivitas enzim.






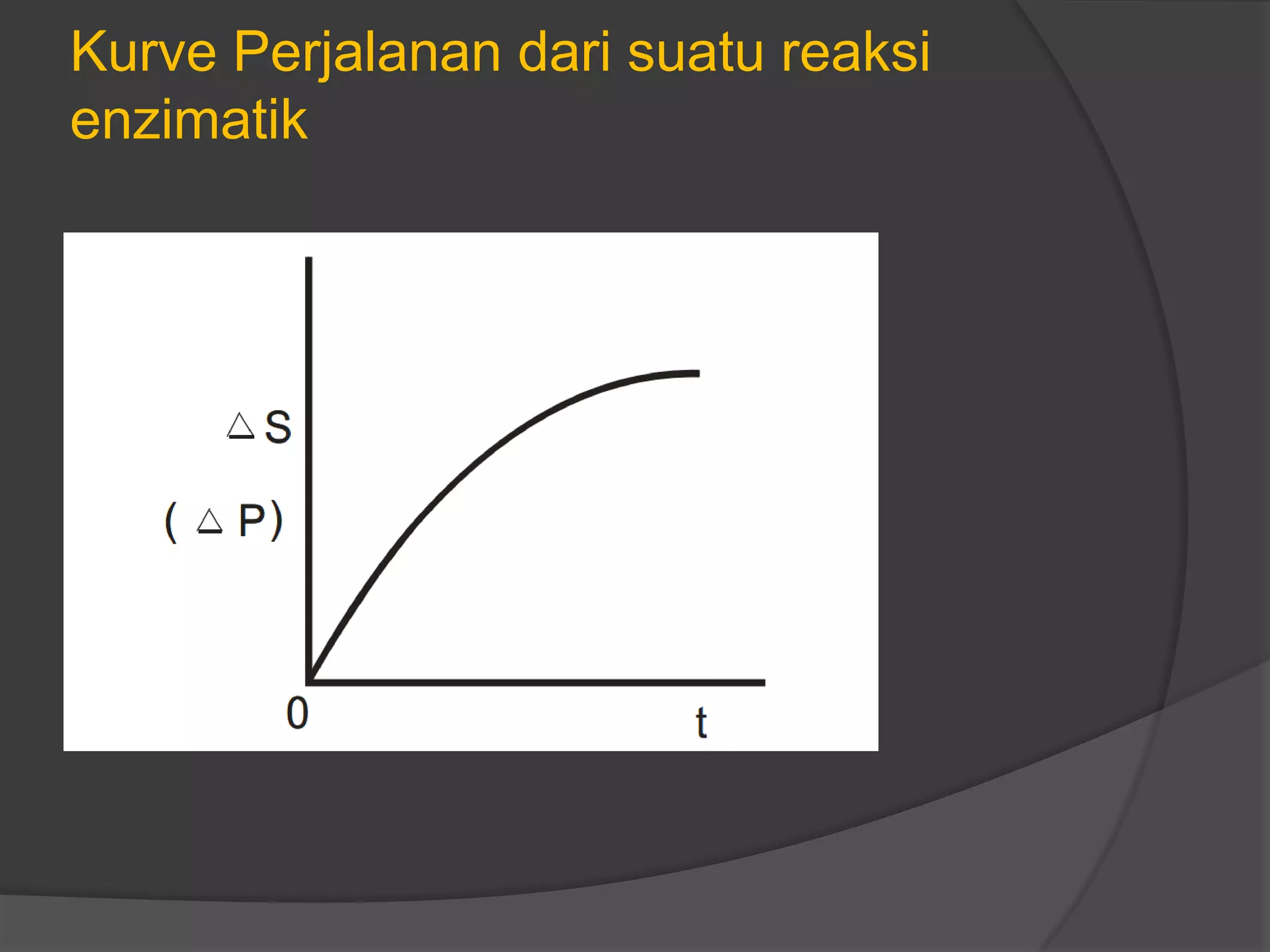
![Dalam reaksi enzim dikenal kecepatan reaksi
hidrolisis, penguraian atau reaksi katalisasi lain
yang disebut velocity (V).
Harga V dari suatu reaksi enzimatis akan meningkat
dengan bertambahnya konsentrasi substrat [S], akan
tetapi setelah [S] meningkat lebih lanjut akan sampai
pada kecepatan yang tetap.](https://image.slidesharecdn.com/kinetikaenzim-140519223957-phpapp01/75/Kinetika-enzim-7-2048.jpg)
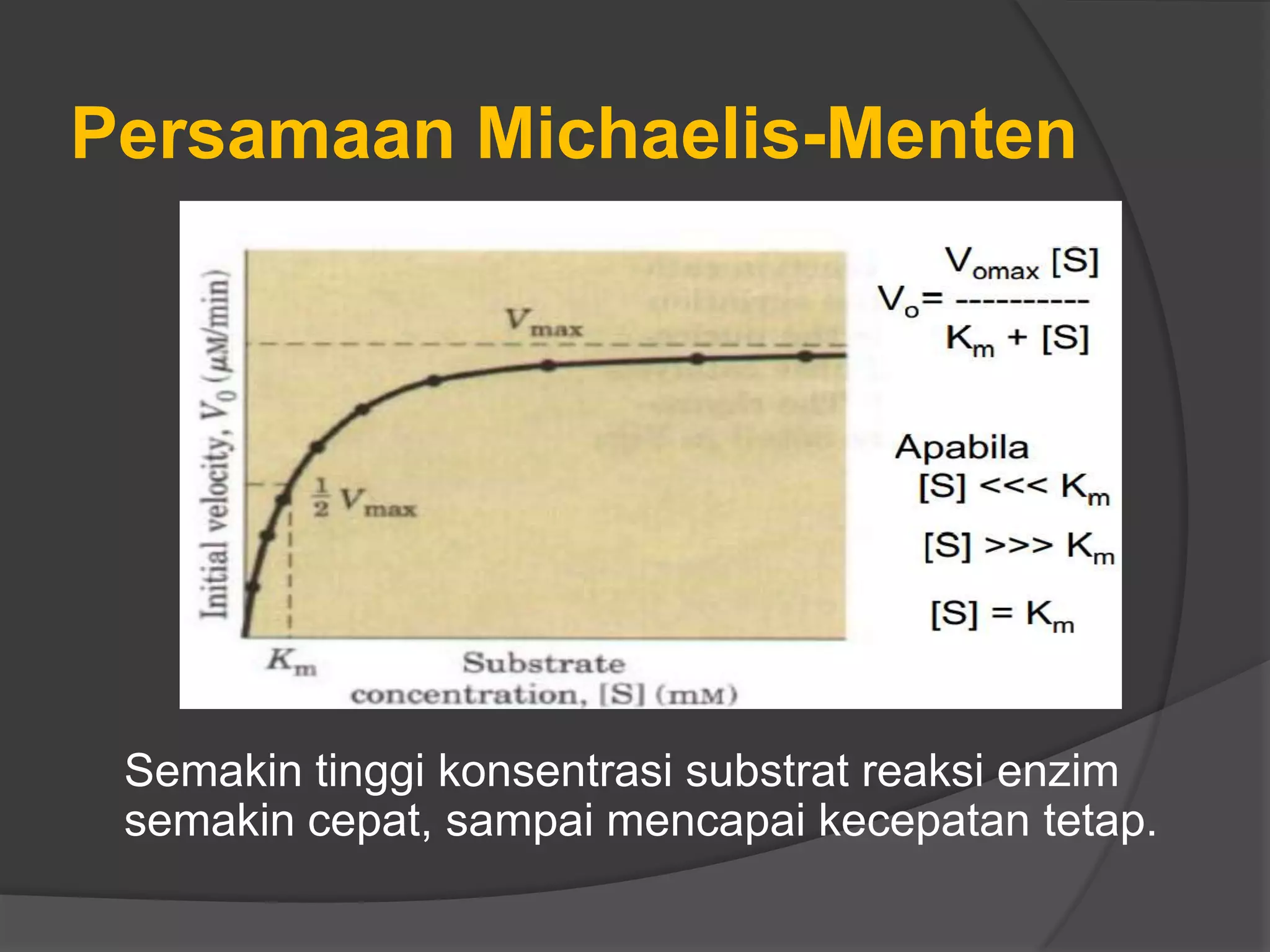
![ Pada konsentrasi enzim tetap (tertentu)
harga V hampir linier dengan [S]. Pada
kondisi dimana V tidak dapat bertambah
lagi dengan bertambahnya [S] disebut
kecepatan maksimum (Vmaks).
(Wiesman, 1989)
Km merupakan konsentrasi substrat yang
separuh dari lokasi aktifnya telah
terisi, yaitu bila kecepatan reaksi enzim
telah mencapai ½ Vmaks
(Wiesman, 1989).](https://image.slidesharecdn.com/kinetikaenzim-140519223957-phpapp01/75/Kinetika-enzim-8-2048.jpg)







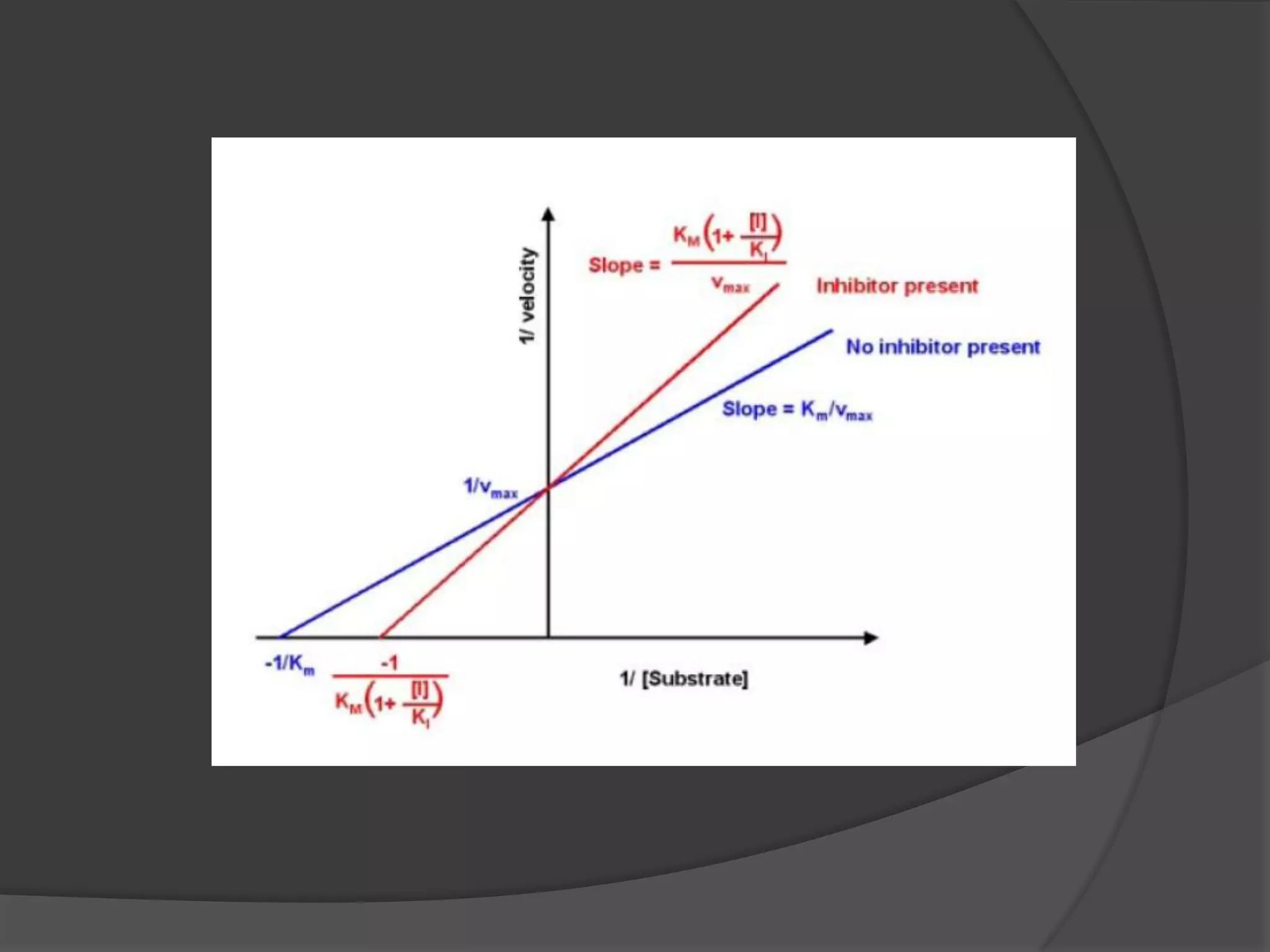
![The double-reciprocal Lineweaver-Burk plot is a linear
transformation of the Michaelis-Menten plot (1/V0 versus
1/[S])](https://image.slidesharecdn.com/kinetikaenzim-140519223957-phpapp01/75/Kinetika-enzim-18-2048.jpg)