Tài liệu cung cấp thông tin về các dẫn xuất halogen, alcol, phenol và ether, bao gồm danh pháp, tính chất lý hóa, cũng như các phản ứng chính và phương pháp điều chế của chúng. Bên cạnh đó, tài liệu cũng nhấn mạnh ý nghĩa y học của một số hợp chất như thyroxin và DDT. Cuối cùng, tài liệu đề cập đến tính acid, tính base, và ứng dụng của phenol và ether trong thực tiễn.





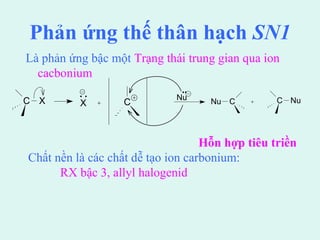
![1. Phản ứng thế thân hạch
R-X + Z → R-Z + X
• + OH → R-OH + X
• + R'O → ROR' Eter (TH Williamson)
• + R'CºC → R-CºC-R Alkin
• + CN → R-CN Nitril
• + R'COO → R'COOR Ester
• + NH3 → R-NH2 Amin
• + Ar-H + AlCl3 → Ar-R Dẫn xuất benzen
• + [CH(COOC2H5)2] → R(CHCOOC2H5)2
(Tổng hợp estermalonic)](https://image.slidesharecdn.com/bmwvoofiriwtuddioeeg-signature-4ce0966d1914298e765fdcdd63d1f95ff9b42aba8f5f051b4c422226f207b743-poli-141026070636-conversion-gate01/85/H-p-ch-t-hydroxy-6-320.jpg)













![3. Phản ứng oxi hóa
Tác nhân oxh mạnh: sulfocromic(K2Cr2O7/H2SO4),
KMnO4/H2SO4, TT Jon (CrO3 + H2SO4/ aceton).
tt Jon
CH3(CH2)6CH2OH CH3(CH2)6 C
O
OH
octanol acid octanoic
tt Jon
OH O
Cyclohexanol Cyclohexanon
CH CH3
OH
C
O
CH3
acetophenon
RCH2OH
[O] RCH
O
[O] RC OH
O
R CH
OH
R' [O]
R C R'
O](https://image.slidesharecdn.com/bmwvoofiriwtuddioeeg-signature-4ce0966d1914298e765fdcdd63d1f95ff9b42aba8f5f051b4c422226f207b743-poli-141026070636-conversion-gate01/85/H-p-ch-t-hydroxy-21-320.jpg)
![*Tác nhân oxy hóa yếu: P.C.C
(Pyridiniumchlorocromat/ hỗn hợp (CrO3+HCl)/ pyridin)
CH3(CH2)6CH2OH CH3(CH2)6 C
octanol octanal
CH3
CH3 C
OH [O]
CH3
CH3 C
O
O
H
CH3 HCOOH
P.C.C
*Alcol bậc 3 khó bị oxi hóa
mạch C có thể bị bẻ gãy](https://image.slidesharecdn.com/bmwvoofiriwtuddioeeg-signature-4ce0966d1914298e765fdcdd63d1f95ff9b42aba8f5f051b4c422226f207b743-poli-141026070636-conversion-gate01/85/H-p-ch-t-hydroxy-22-320.jpg)









![4. Phản ứng tạo màu với FeCl3
màu tùy thuộc vào cấu trúc của phenol
6C6H5OH +FeCl3 → [Fe(OC6H5)6]3- + 3Cl- + 6H+
phức chất màu xanh hoặc xanh tím](https://image.slidesharecdn.com/bmwvoofiriwtuddioeeg-signature-4ce0966d1914298e765fdcdd63d1f95ff9b42aba8f5f051b4c422226f207b743-poli-141026070636-conversion-gate01/85/H-p-ch-t-hydroxy-32-320.jpg)
![5. Phản ứng oxi hóa
Phenol để lâu ngày thường có màu nâu xẩm
- Với KMnOOH
4
[O]
- Với H2O2 hoặc acid cromic
COOH
COOH
acid muconic
OH
[O]
OH
OH
[O]
O
O
[O]
COOH
COOH
p_hydroquinon p_benzoquinon acid oxalic](https://image.slidesharecdn.com/bmwvoofiriwtuddioeeg-signature-4ce0966d1914298e765fdcdd63d1f95ff9b42aba8f5f051b4c422226f207b743-poli-141026070636-conversion-gate01/85/H-p-ch-t-hydroxy-33-320.jpg)




![2. Phản ứng oxi hóa
Ether trong không khí dễ tạo thành
peroxyd hữu cơ, dễ gây nổ
C2H5 O C2H5
[O] CH3 CH O O CH CH3
OH OH
peroxid oxy ethyl](https://image.slidesharecdn.com/bmwvoofiriwtuddioeeg-signature-4ce0966d1914298e765fdcdd63d1f95ff9b42aba8f5f051b4c422226f207b743-poli-141026070636-conversion-gate01/85/H-p-ch-t-hydroxy-38-320.jpg)











