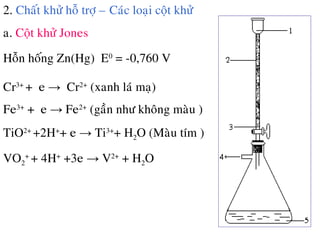
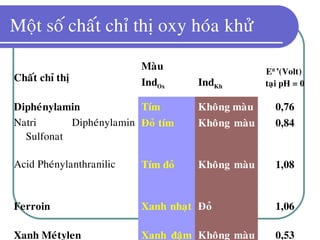
Tài liệu trình bày về phương pháp chuẩn đoán oxy hóa khử và các phản ứng oxi hóa khử liên hợp, nhấn mạnh lên các phương pháp phân tích phản ứng cũng như nguyên tắc xác định điểm tương đương trong quá trình chuẩn độ. Nó cũng đề cập đến các yếu tố ảnh hưởng đến độ chính xác của phép chuẩn độ và một số chỉ dẫn về việc thực hiện các phép thử oxy hóa khử trong thực nghiệm. Cuối cùng, tài liệu liệt kê các chất oxy hóa khử và mô tả cách sử dụng chúng để xác định các thành phần trong mẫu.




![Theá oxy hoùa khöû-Phöông trình Nerst
Theá oxy hoùa - khöû cuûa moät caëp oxy hoaù - khöû
lieân hôïp caøng cao thì chaát oxy hoùa cuûa caëp aáy
caøng maïnh vaø chaát khöû caøng yeáu
Ox + ne → Kh
][
][
lg
059,00
Kh
Ox
n
EE +=](https://image.slidesharecdn.com/chng3-140615221314-phpapp01/85/Ch-ng-3-ph-ng-phap-chu-n-d-oxy-hoa-kh-5-320.jpg)
![VÍ DUÏ
Vieát bieåu thöùc theá oxy hoùa - khöû cuûa caùc
caëp oxy hoùa - khöû sau ôû 250
C
a. Cu2+
/Cu
b. MnO4
-
, H+
/ Mn2+
, H2O
]lg[
2
059,0 20
// 22
+
+= ++ CuEE CuCuCuCu
][
]][[
lg
5
059,0
2
8
40
,/,,/, 2
2
42
2
4 +
+−
+= ++−++−
Mn
HMnO
EE OHMnHMnOOHMnHMnO](https://image.slidesharecdn.com/chng3-140615221314-phpapp01/85/Ch-ng-3-ph-ng-phap-chu-n-d-oxy-hoa-kh-6-320.jpg)



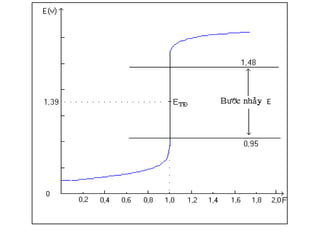
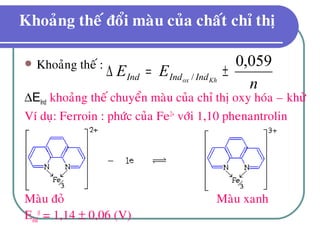
![Khoaûng theá ñoåi maøu cuûa chaát chæ thò
IndOx + ne → IndKh
dung dòch coù maøu cuûa daïng IndOx khi:
dung dòch coù maøu cuûa daïng IndKh khi
][Ind
][Ind
lg
059,0
Kh
Ox0
//0
n
EE KhoxKhx IndIndIndInd +=
⇒≥ 10
][Ind
][Ind
Kh
Ox
n
EE KhoxKhox IndIndIndInd
059,00
// +>
⇒<
10
1
][Ind
][Ind
Kh
Ox
n
EE KhoxKhox IndIndIndInd
059,00
// −<](https://image.slidesharecdn.com/chng3-140615221314-phpapp01/85/Ch-ng-3-ph-ng-phap-chu-n-d-oxy-hoa-kh-10-320.jpg)
![III / ÑÖÔØNG CHUAÅN ÑOÄ TRONG
PHEÙP CHUAÅN ÑOÄ QXY HOÙA -KHÖÛ
aKh1 + bOx2 == aOx1 + bKh2
Kh1 − b.e =
Ox1
Ox2 + a.e =
Kh2
][
][
lg
059,0
1
10
/ 11
Kh
Ox
b
EE KhOx +=
][
][
lg
059,0
2
20
/ 22
Kh
Ox
a
EE KhOx +=
00VN
NV
F =](https://image.slidesharecdn.com/chng3-140615221314-phpapp01/85/Ch-ng-3-ph-ng-phap-chu-n-d-oxy-hoa-kh-13-320.jpg)
![ Tröôùc ñieåm töông ñöông
Tính theá dung ñòch theo caëp Ox1/ Kh1
F
F
b −
+=
1
lg
059,0
EE 0
1
][
][
lg
059,0
1
10
1
0
kh
oxh
b
EE +=
][
][
lg
059,0
1
10
1
kh
oxh
b
b
b
E +=
VV
NV
oxhb
+
=
0
1 ][
VV
NVVN
khb
+
−
=
0
00
1 ][
NVVN
NV
b
EE
−
+=⇒
00
0
1
0
lg
059,0](https://image.slidesharecdn.com/chng3-140615221314-phpapp01/85/Ch-ng-3-ph-ng-phap-chu-n-d-oxy-hoa-kh-14-320.jpg)
![Taïi ñieåm töông ñöông
Theá cuûa hai caëp Ox1/Kh1 vaø Ox2/Kh2 caân baèng neân tính
theá dung dòch theo caû hai caëp
][
][
lg
059,0
1
10
1
Kh
Ox
b
EE += ][
][
lg
059,0
2
20
2
Kh
Ox
a
EE +=
][
][
lg059,0
2
20
1
Kh
Ox
aEaE +=
][
][
lg059,0
1
10
1
Kh
Ox
bEbE +=
b [Ox1] = a [Kh2]
b [Kh1] = a [Ox2]
1
]].[[
]][[
21
21
=
KhKh
OxOx
ba
aEbE 0
2
0
1
+
+
=TDE](https://image.slidesharecdn.com/chng3-140615221314-phpapp01/85/Ch-ng-3-ph-ng-phap-chu-n-d-oxy-hoa-kh-15-320.jpg)
![Sau ñieåm töông ñöông
Tính theá dung dòch theo caëp Ox2/Kh2
)1lg(
059,0
EE 0
2 −+= F
a
][
][
lg
059,0
2
20
2
0
kh
oxh
a
EE +=
][
][
lg
059,0
2
20
2
kh
oxh
a
a
a
E +=
VV
VNNV
oxha
+
−
=
0
00
2 ][
VV
VN
kha
+
=
0
00
2 ][
00
000
2
0
lg
059,0
VN
VNNV
a
EE
−
+=⇒](https://image.slidesharecdn.com/chng3-140615221314-phpapp01/85/Ch-ng-3-ph-ng-phap-chu-n-d-oxy-hoa-kh-16-320.jpg)

![GIAÛI
Phaûn öùng chuaån ñoä :
MnO4
-
+ 5Fe2+
+ 8H+
= Mn2+
+ 5Fe3+
+ 4H2O
Ñöôïc phaân tích thaønh 2 baùn phaûn öùng :
Fe2+
− 1e = Fe3+
MnO4
-
+ 5e + 8H+
= Mn2+
+ 4H2O
][
][
lg
1
059,0
2
3
0
/ 23
+
+
+= ++
Fe
Fe
EE FeFe
][
][
lg
5
059,0
2
40
/8, 2
4 +
−
+= ++−
Mn
MnO
EE MnHMnO](https://image.slidesharecdn.com/chng3-140615221314-phpapp01/85/Ch-ng-3-ph-ng-phap-chu-n-d-oxy-hoa-kh-18-320.jpg)