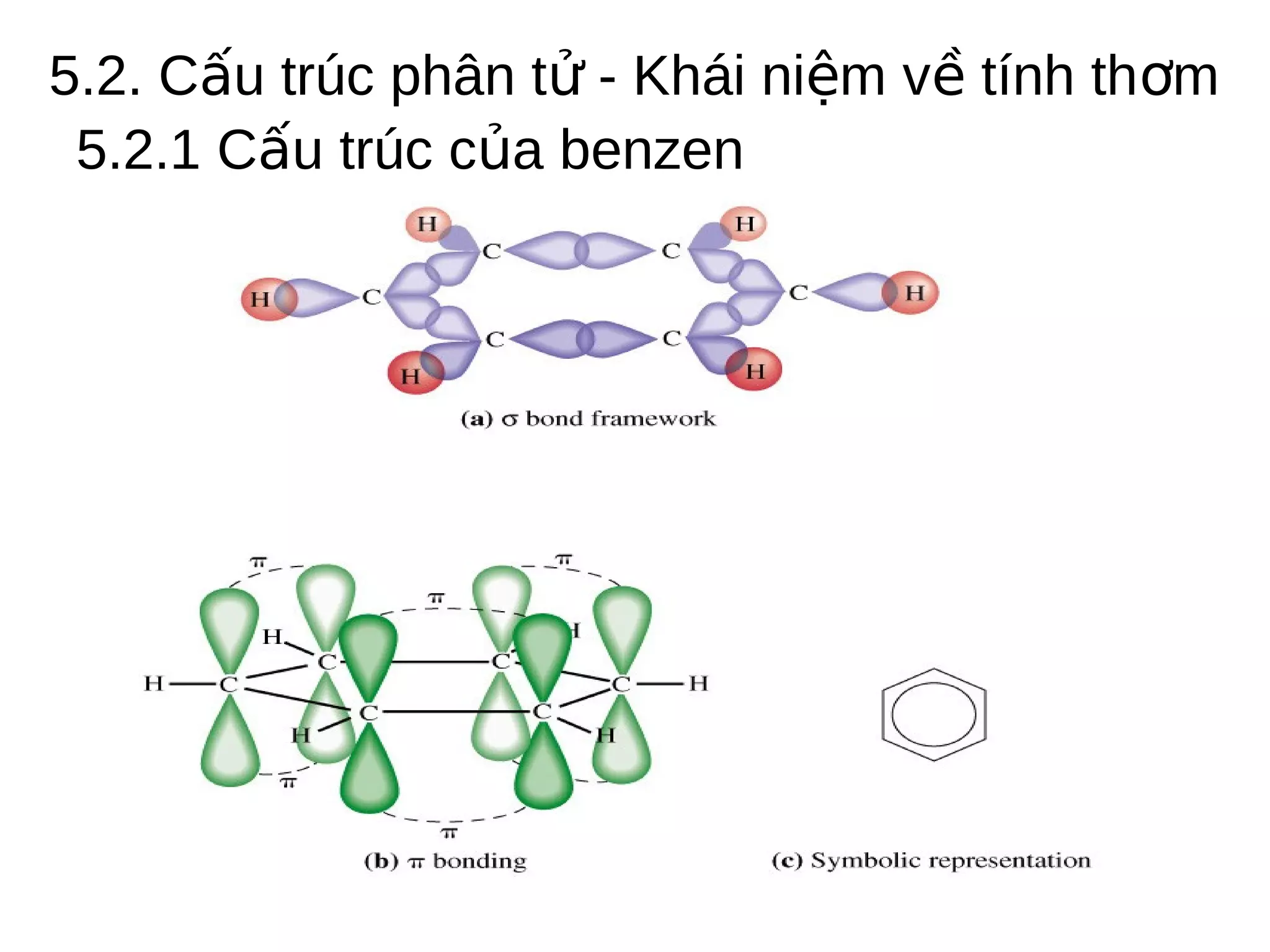
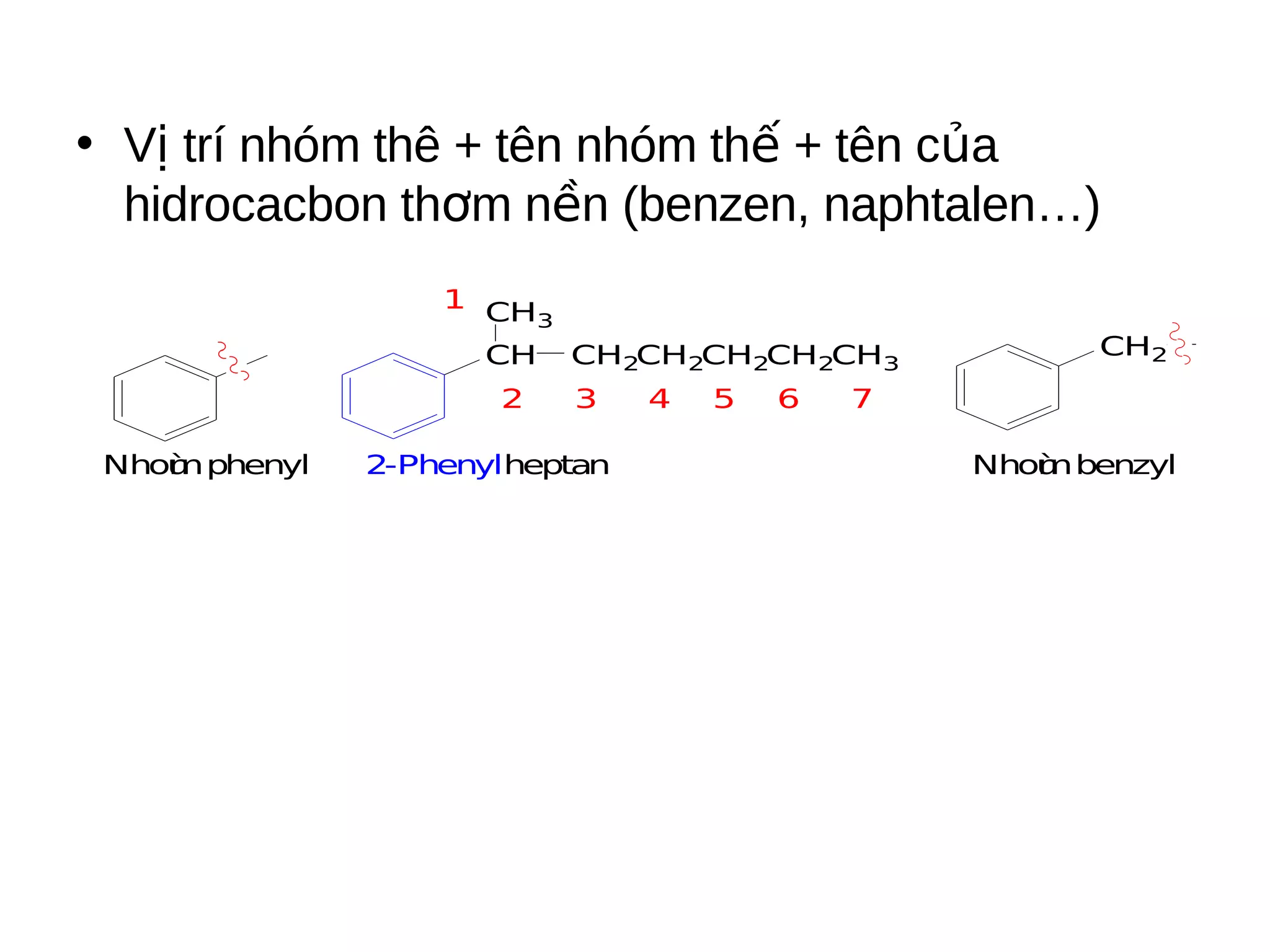
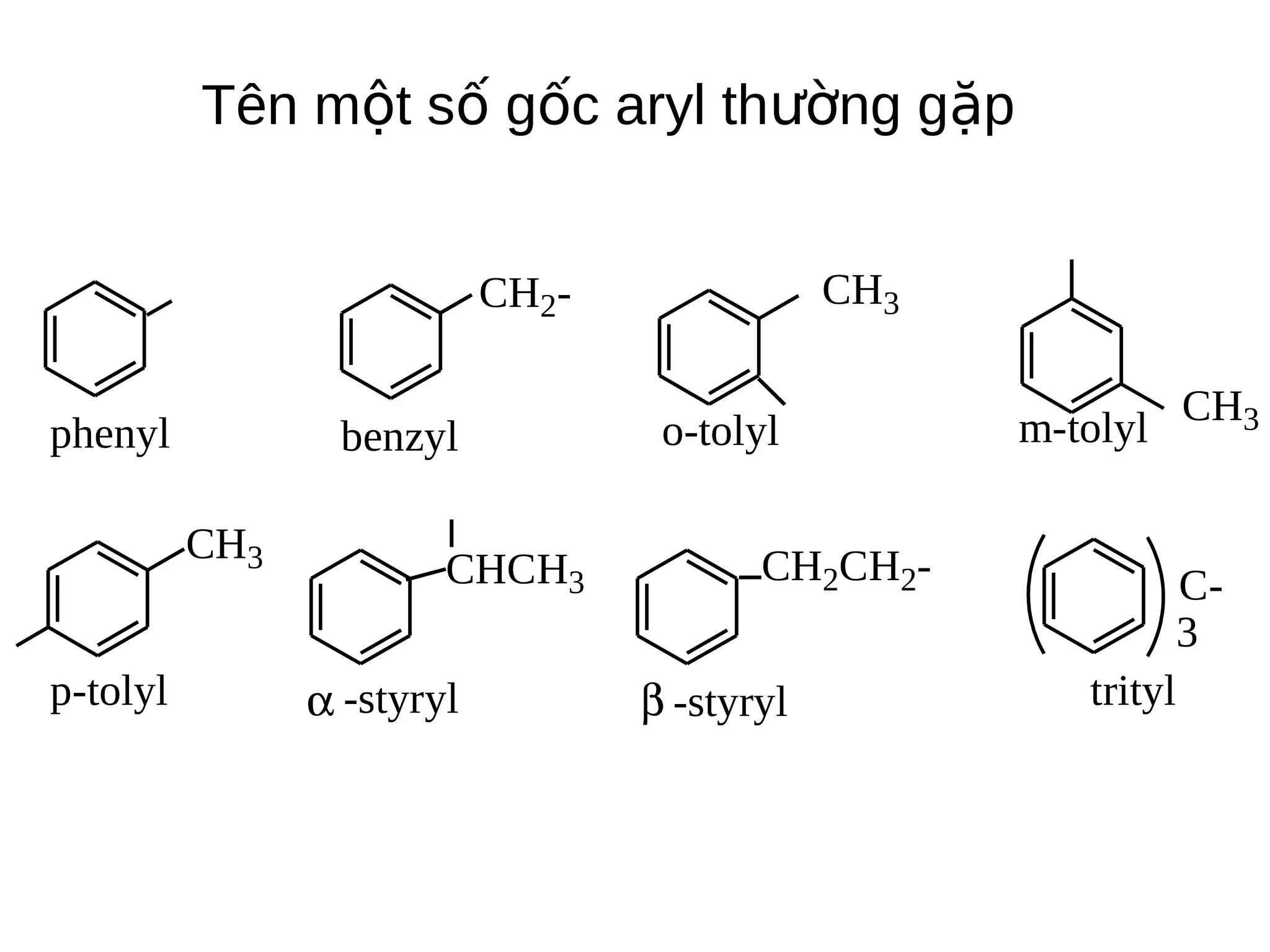
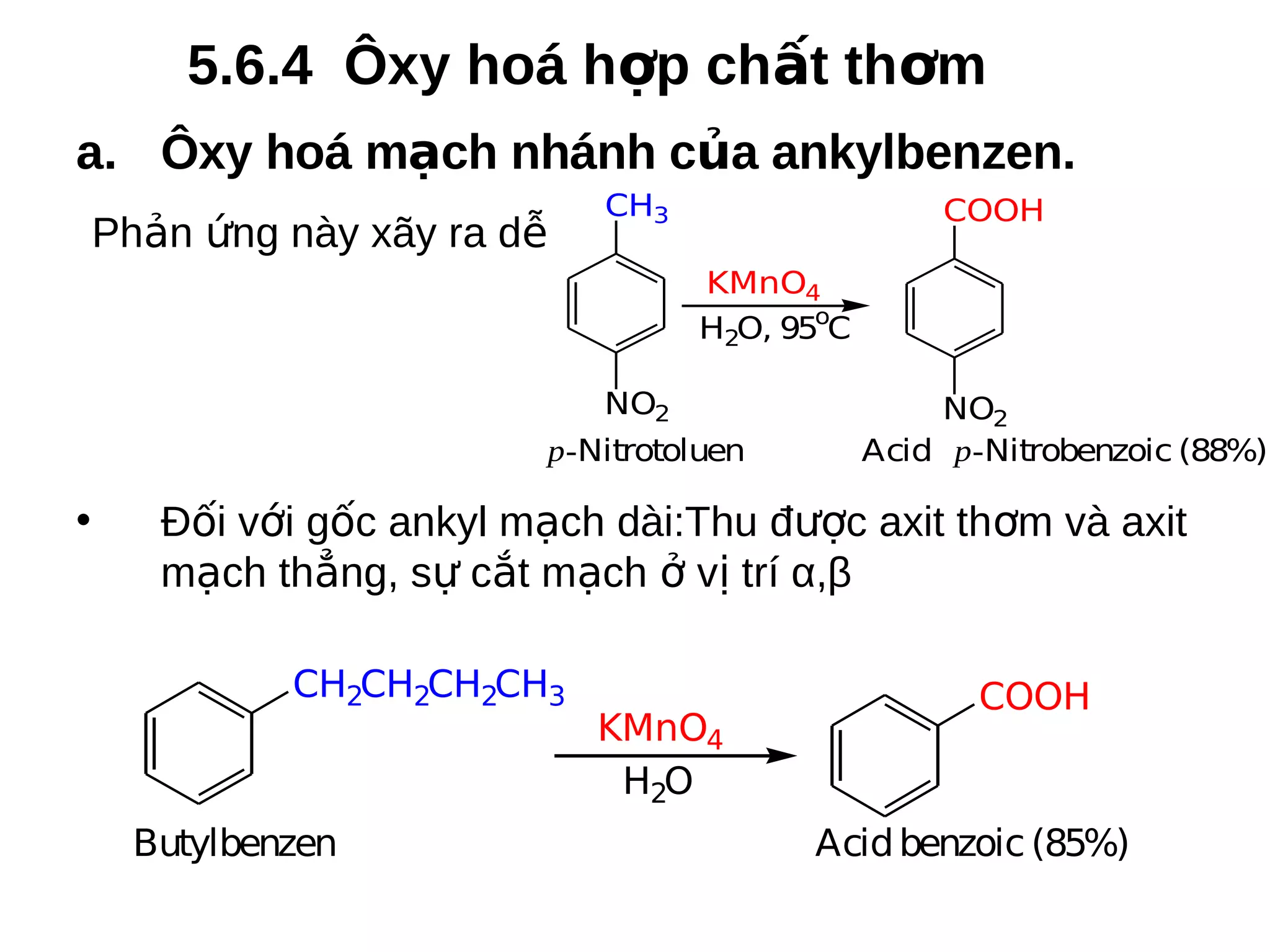
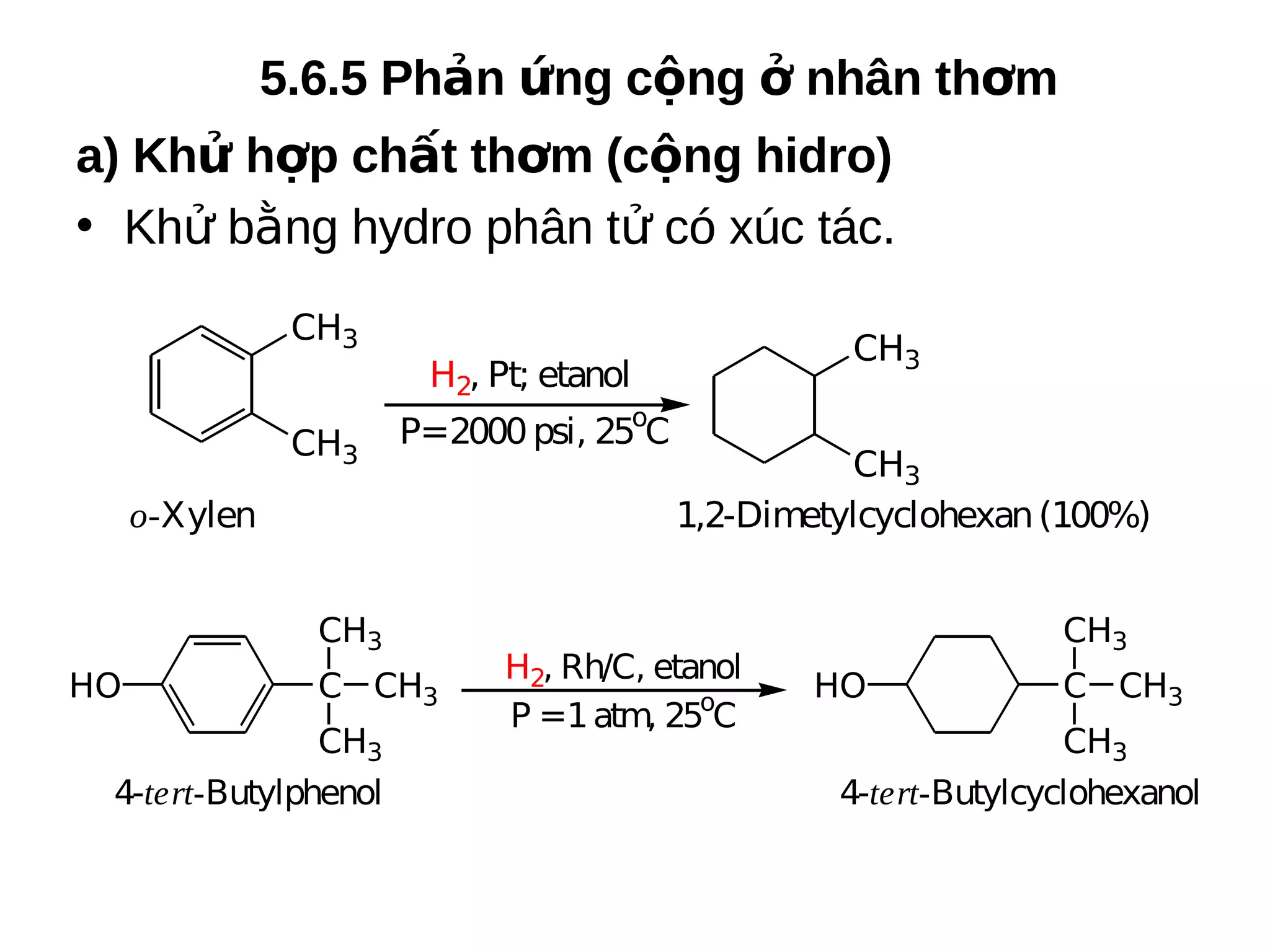
Chương 5 trình bày về hiđrocacbon thơm (aren), định nghĩa, cấu trúc, tính chất và các phương pháp điều chế của chúng. Nó cũng chi tiết về danh pháp, đồng phân, cũng như các phản ứng hóa học liên quan như phản ứng thế, phản ứng xê dịch và phản ứng oxy hóa. Cuối cùng, chương này thảo luận về cơ chế và quy tắc định hướng trong phản ứng của các hợp chất thơm.