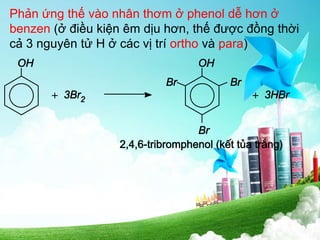
Ancol là hợp chất hữu cơ chứa nhóm hiđroxyl và được phân loại theo bậc, số nhóm chức và cấu tạo gốc hiđrocacbon. Tính chất vật lý của ancol cho thấy sự tan trong nước giảm khi số nguyên tử carbon tăng, trong khi tính chất hóa học của chúng thể hiện qua phản ứng với kim loại kiềm và oxi hóa. Phenol, có tính axit yếu hơn ancol, được điều chế chủ yếu từ benzen và được sử dụng trong sản xuất dược phẩm, chất kết dính và chất diệt nấm.