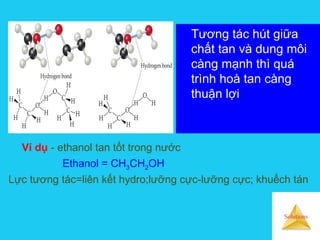
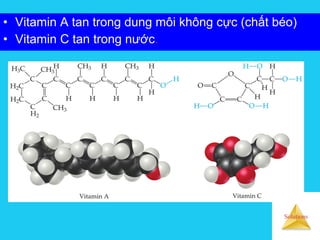
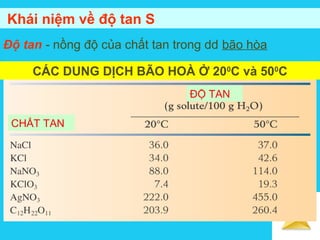
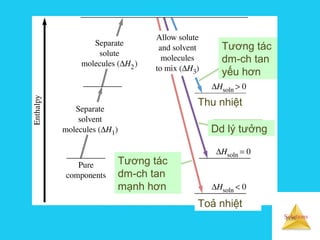
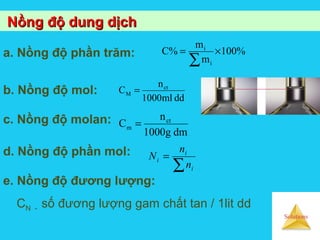
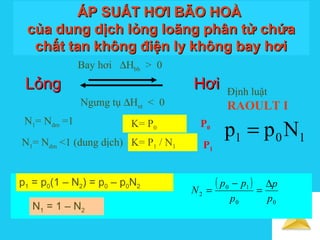
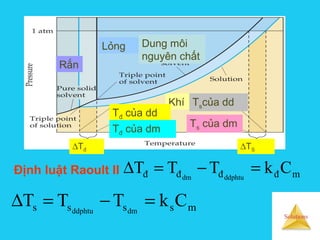
Tài liệu trình bày về cân bằng trong dung dịch lỏng, bao gồm các khái niệm cơ bản về hệ phân tán, đặc điểm của dung dịch, và cơ chế tạo thành dung dịch. Nó cũng thảo luận về độ tan, các yếu tố ảnh hưởng đến độ tan, áp suất hơi bão hòa của dung dịch, và sự khác biệt giữa dung dịch điện ly và dung dịch lỏng phân tử. Cuối cùng, nó đề cập đến các định luật liên quan như định luật Raoult và Van't Hoff trong các dung dịch lý tưởng và thực.































![Solutions
Dung dịch điện ly dẫn điện
Độ dẫn điện riêng χ - 1cm3
dd (s=1cm2
;d=1cm)
[ ]11
cmom
1 −−
ρ
=χ
χ=χ=λ
NC
1000
V.
Khi pha loãng → λ tăng
Khi pha loãng vô cùng → λ∞ = const
Độ dẫn điện đương lượng λ - V cm3
(1đlgam ctan)
Khi pha loãng → χ giảm](https://image.slidesharecdn.com/bgdungdich-160122173426/85/Bai-giang-dung-dich-47-320.jpg)







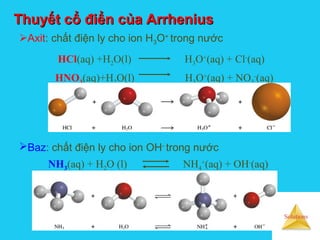
![Solutions
CÂN BẰNG TRONG DD CHẤT ĐIỆN LY YẾUCÂN BẰNG TRONG DD CHẤT ĐIỆN LY YẾU
AmBn(dd) mAn+
(dd) + nBm-
(dd)
Qt ion hoá
Qt phân tử hoá
Hằng số điện ly
[ ] [ ]
[ ]nm
nmmn
BA
B.A
K
−+
=
Hằng số điện ly là hs cân bằng của qt điện ly nên là đlg đặc
trưng cho mỗi chất điện ly và dung môi, phụ thuộc vào nhiệt độ.
Axit – hsđly ký hiệu Ka
Baz – hsđly ký hiệu Kb
Đặc trưng cho cường độ
Axit - base
Trong dd nước: Ka,Kb < 10-4
→ axit yếu, base yếu
Biểu thức của
đl tác dụng
khối lượng](https://image.slidesharecdn.com/bgdungdich-160122173426/85/Bai-giang-dung-dich-55-320.jpg)



 = 3K+
(dd) + [Fe(CN)6]3-
(dd)
[Fe(CN)6]3-
(dd) Fe3+
(dd) + 6CN-
(dd)
[ ][ ]
[ ]−
−+
= 3
6
63
kb
)CN(Fe
CNFe
KHằng số không bền của phức
[ ]
[ ][ ]63
3
6
kb
b
CNFe
)CN(Fe
K
1
K
−+
−
==Hằng số bền của phức
Fe3+
(dd) + 6CN-
(dd) [Fe(CN)6]3-
(dd)](https://image.slidesharecdn.com/bgdungdich-160122173426/85/Bai-giang-dung-dich-59-320.jpg)





![Solutions
Tích số tan và độ tan của chất điện ly khóTích số tan và độ tan của chất điện ly khó
tan.tan.
( ) ( ) ( )
−+
+↔ m
dd
n
ddrnm nBmABA
S[mol/l] mS nS
( )nm
nm
BA
nm
T
S nm+
=
( ) ( )
( )nmnm
nm
n
B
m
ABA
Snm
nSmS
CCT mn
nm
+
=
×=
×= −+
Độ tan
trong nước](https://image.slidesharecdn.com/bgdungdich-160122173426/85/Bai-giang-dung-dich-66-320.jpg)


![Solutions
Sự ion hóa và tích số ion của nướcSự ion hóa và tích số ion của nước
Độ dẫn điện của H2O = 5,54.10-18
Ω-1
.cm-1
H2O + H2O H3O+
+ OH-
14
3n 10]OH][OH[K −−+
==
pH=-lg[H+
] pOH=-lg[OH-
] pK=-lgK
pKn = pH+ POH = 14](https://image.slidesharecdn.com/bgdungdich-160122173426/85/Bai-giang-dung-dich-69-320.jpg)
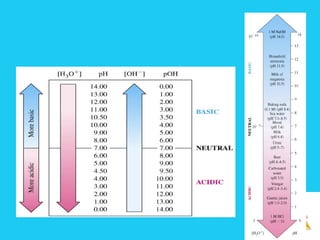
![Solutions
Chỉ số pH và môi trường ddChỉ số pH và môi trường dd
Trong nước nguyên chất và môi trường trung tính
[H+
] = [OH-
] = 10-7
pH = 7
Trong dung dịch axit có môi trường axit
[H+
] > [OH-
] pH < 7
Trong dung dịch baz có môi trường baz
[H+
] < [OH-
] pH > 7](https://image.slidesharecdn.com/bgdungdich-160122173426/85/Bai-giang-dung-dich-70-320.jpg)





![Solutions
H2O + H2O H3O + OH-
kn= [OH-
][H3O+
]
NH3 + NH3 NH2
-
+ NH4
+
kd= [NH2
-
][NH4
+
]
HD + HD D-
+ H2D+
Kd = [D-
][H2D+
]](https://image.slidesharecdn.com/bgdungdich-160122173426/85/Bai-giang-dung-dich-80-320.jpg)
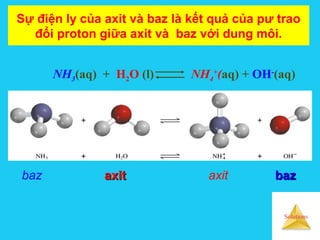
![Solutions
Sự điện ly của axit và baz trong nướcSự điện ly của axit và baz trong nước
Axit: HA + H2O A-
+ H3O+
[ ][ ]
[ ]HA
AOH
K 3
a
−+
=
Baz: B + H2O BH+
+ OH-
[ ][ ]
[ ]B
OHBH
Kb
−+
=
Ka càng lớn thì tính
axit càng mạnh
Kb càng lớn thì tính
baz càng mạnh](https://image.slidesharecdn.com/bgdungdich-160122173426/85/Bai-giang-dung-dich-82-320.jpg)
![Solutions
Đối với cặp axit – baz liên hợp:
HA + H2O A-
+ H3O+
][
]][[ 3
)(
HA
AOH
K HAa
−+
=
A-
+ H2O HA + OH-
][
]][[
)( −
−
=−
A
OHHA
K Ab
nAbHAa KOHOH
A
OHHA
x
HA
AOH
KK === −+
−
−−+
− ]][[
][
]][[
][
]][[
3
3
)()(
pKa + pKb = pKn = 14
Ka.Kb = Kd → pKa + pKb = pKd
Axit càng mạnh (Ka↑) thì baz liên hợp là baz yếu(Kb↓)
Axit càng yếu (Ka↓) thì baz liên hợp là baz mạnh (Kb↑)
Ka.Kb = Kn](https://image.slidesharecdn.com/bgdungdich-160122173426/85/Bai-giang-dung-dich-83-320.jpg)
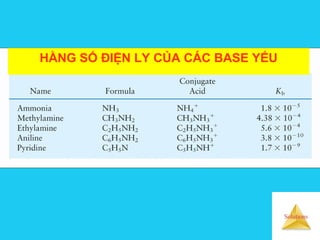
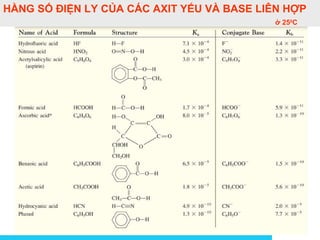
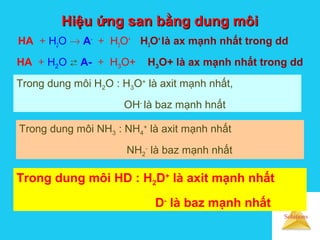
![Solutions
Ảnh hưởng của dung môi đếnẢnh hưởng của dung môi đến
cường độ axit bazcường độ axit baz
Hằng số tự proton hoá (Kd )
HD + HD D-
+ H2D+
Kd = [D-
][H2D+
]
Kd càng lớn thì tính axit của dung môi càng mạnh.
Ái lực proton (AP) HD + H+
=H2D+
∆H = -AP
AP càng lớn thì dung môi có tính baz càng mạnh](https://image.slidesharecdn.com/bgdungdich-160122173426/85/Bai-giang-dung-dich-87-320.jpg)


![Solutions
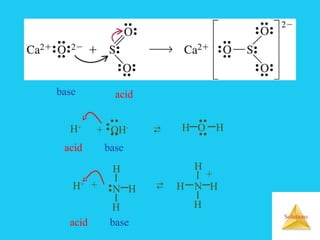
Dự đoán baz Lewis:
Các anion : Cl-
, Br-
, OH-
Phân tử trung hoà hay ion có chứa nguyên tử (N,O )
còn cặp e hoá trị tự do như : NH3, amin , rượu, xeton..
Base Lewis: chất cho cặp electron.
N H
••
H
H
acid base
F B
F
F
+
F B
F
F
N H
H
H
Ag+
+ 2NH3 [Ag(NH3)2]+
□](https://image.slidesharecdn.com/bgdungdich-160122173426/85/Bai-giang-dung-dich-90-320.jpg)
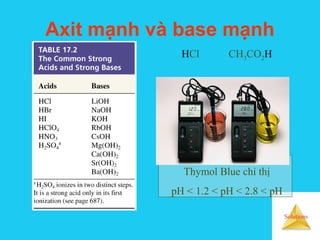
![Solutions
HCl, axit mạnh HF, axit yếu
[H+
] = [HCl] [H+
] < [HF]](https://image.slidesharecdn.com/bgdungdich-160122173426/85/Bai-giang-dung-dich-92-320.jpg)

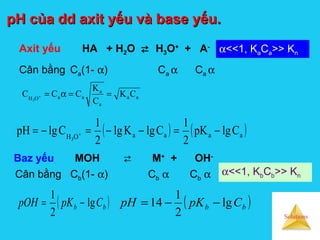
![Solutions
Đối với axit , base yếu đa bậcĐối với axit , base yếu đa bậc
Khi tính pH dung dịch ta chỉ dựa vào bậc phân ly
thứ nhất
7
a 10.3,4K 1
−
=Ví dụ : tính pH dung dịch H2CO3 0,01M .
[ ] ( )[ ] 19,410lg10.3,4lg
2
1
ClgpK
2
1
pH 27
aa1
=−−=−= −−](https://image.slidesharecdn.com/bgdungdich-160122173426/85/Bai-giang-dung-dich-96-320.jpg)
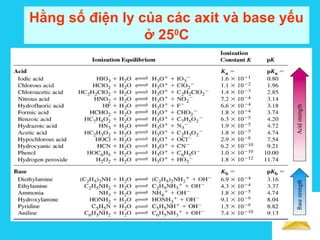



![Solutions
CH3COONa → CH3COO- + Na+
Cm Cm
CH3COOH + H2O CH3COO-
+ H3O+
Ca(1-α) (Caα + Cm≈ Cm) Caα
pH của dung dịch đệm axit ( HA + MA)
a
m
a
m
a
a3
C
C
lgpK
C
C
lgKlg]OHlg[pH +=−−=−= +
[ ][ ]
[ ]
[ ]
a
m3
3
33
a
C
COH
COOHCH
COOCHOH
K
+−+
==
m
a
a3
C
C
K]OH[ =+
PH của dd đệm base ( MOH + MA )
+−=
b
m
b
C
C
lgpK14pH](https://image.slidesharecdn.com/bgdungdich-160122173426/85/Bai-giang-dung-dich-101-320.jpg)
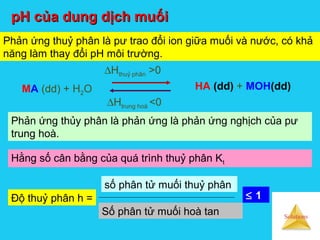


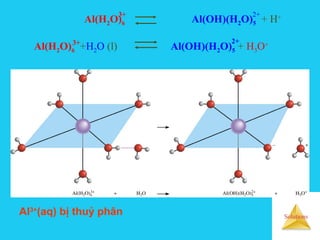
![Solutions
Cation cấu hình khí trơ có q2
/ r càng lớn → tính axit càng
mạnh nên thuỷ phân càng mạnh.
Ví dụ : Ka[Mg2+
(aq)] > Ka[Ba2+
(aq)] → Mg2+
(aq) thuỷ phân
mạnh hơn Ba2+
(aq).
Cation có điện tích và bán kính tương đương, cấu hình: 18e
– (18e +2e) – (18e> >8e ) → tính axit mạnh hơn cấu hình 8e
nên thuỷ phân sẽ mạnh hơn
Ví dụ : Mg2+
(aq) thuỷ phân yếu hơn Hg2+
(aq)](https://image.slidesharecdn.com/bgdungdich-160122173426/85/Bai-giang-dung-dich-105-320.jpg)



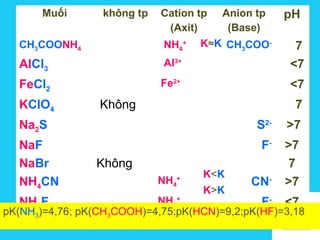
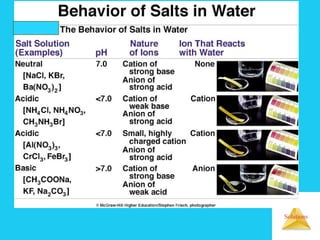
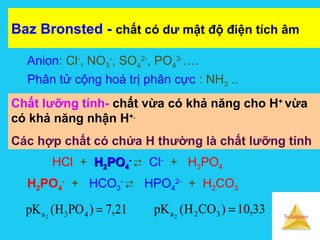
![Solutions
Muối tạo thành từMuối tạo thành từ axit yếuaxit yếu (K(Kaa)) vàvà baz mạnhbaz mạnh PH >7PH >7
Sự điện ly:MA → M+
(axy) + A-
(base mạnh hơn H2O)
Sự thủy phân: A-
+ H2O ⇌ HA + OH-
Cm(1-h) Cmh Cmh
Hằng số thủy phân:
Độ thủy phân:
Tính pH:
[ ][ ]
[ ]
[ ]
[ ][ ] [ ][ ]
a
n
t
K
K
OHH
AH
HA
A
OHHA
K =×== −+
−+−
−
[ ][ ]
[ ]
( )
( )
2
m
2
m
m
2
m
t hC
h1
hC
h1C
hC
A
OHHA
K ≈
−
=
−
== −
−
ma
n
m
t
CK
K
C
K
h ==
[ ]
a
mn
ma
n
mm
K
CK
CK
K
ChCOH ===−
[ ] [ ] m
ann
C
KK
OH
K
H == −
+
( ) ( )maman ClgpK
2
1
7ClgpKpK
2
1
pH ++=++= >7](https://image.slidesharecdn.com/bgdungdich-160122173426/85/Bai-giang-dung-dich-111-320.jpg)
![Solutions
Muối tạo thành từMuối tạo thành từ axit mạnhaxit mạnh vàvà baz yếubaz yếu (K(Kbb)) pH<7pH<7
Sự điện ly: MA → M+
(axit mạnh hơn nước) + A-
(basey)
Sự thủy phân: M+
+ H2O ⇌ MOH + H+
Cm(1-h) Cmh Cmh
Hằng số thủy phân:
Độ thủy phân:
Tính pH:
[ ][ ]
[ ]
[ ]
[ ][ ] [ ][ ]
b
n
t
K
K
OHH
OHM
MOH
M
HMOH
K =×== −+
−++
+
[ ][ ]
[ ]
( )
( )
2
m
2
m
m
2
m
t hC
h1
hC
h1C
hC
M
HMOH
K ≈
−
=
−
== +
+
mb
n
m
t
CK
K
C
K
h ==
[ ]
b
mn
mb
n
mm
K
CK
CK
K
ChCH ===+
( ) ( )mbmbn ClgpK
2
1
7ClgpKpK
2
1
pH +−=−−= <7](https://image.slidesharecdn.com/bgdungdich-160122173426/85/Bai-giang-dung-dich-112-320.jpg)
![Solutions
Muối tạo thành từ axit yếu (Ka) và base yếu (Kb)
Sự điện ly:MA → M+
(axit mạnh hơn nước) + A-
(base mạnh hơn nước)
Sự thủy phân: M+
+ A-
+ H2O ⇌ HA + MOH
Cm(1-h) Cm(1-h) Cmh Cmh
Hằng số thủy phân:
Độ thủy phân:
Tính pH:
[ ][ ]
[ ][ ]
[ ]
[ ][ ]
[ ]
[ ][ ] [ ][ ]
ba
n
t
KK
K
OHH
OHM
MOH
AH
HA
AM
MOHHA
K =××== −+
−+−+−+
[ ][ ]
[ ][ ]
( )
( ) ( )
2
2
2
22
m
2
m
t h
h1
h
h1C
hC
AM
MOHHA
K ≈
−
=
−
== −+
ba
n
t
KK
K
Kh ==
[ ] [ ]
[ ] b
an
ba
n
aaa
m
m
aa
K
KK
KK
K
KhK
h1
h
K
)h1(C
hC
K
A
HA
KH ==≈
−
×=
−
×=×= −
+
( ) ( )baban pKpK
2
1
7pKpKpK
2
1
pH −+=−+=](https://image.slidesharecdn.com/bgdungdich-160122173426/85/Bai-giang-dung-dich-113-320.jpg)





