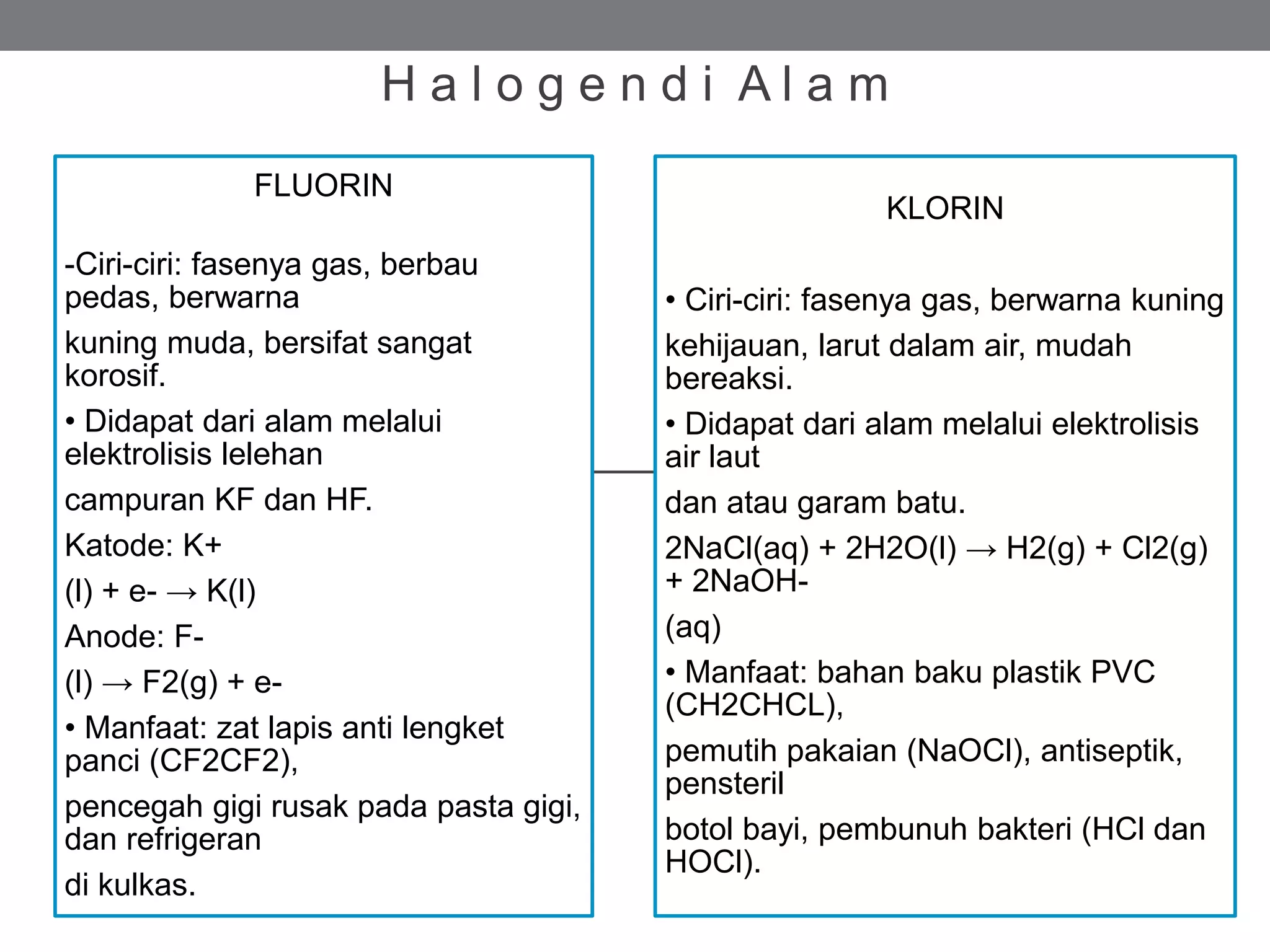
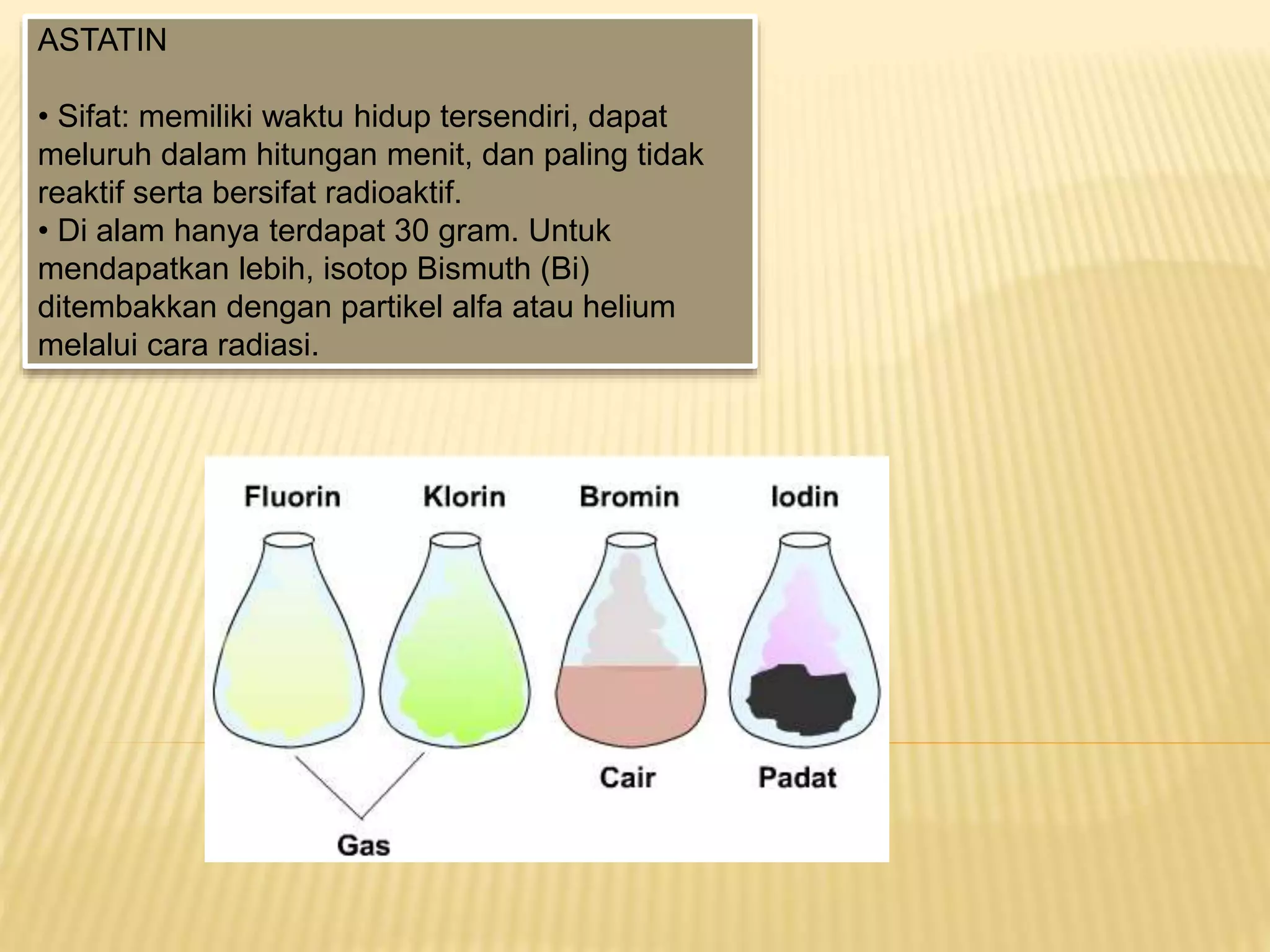
Halogen adalah unsur nonlogam paling reaktif yang tidak ditemukan bebas di alam dan termasuk dalam golongan VIIA. Setiap halogen memiliki karakteristik dan manfaat berbeda, seperti fluor untuk pencegahan gigi rusak, klorin sebagai pemutih, dan bromin dalam film fotografi. Sifat fisika dan kimia halogen meliputi titik didih, energi ionisasi, keelektronegatifan, serta reaksi mereka dengan logam, hidrogen, dan air.


![Pengertian :perubahan yang dialami suatu benda tanpa membentuk zat
baru. Sifat ini dapat diamati tanpa mengubah zat-zat penyusun materi
tersebut. Sifat fisika antara lain wujud zat, warna, bau, titik leleh, titik
didih, massa jenis, kekerasan, kelarutan, kekeruhan, kemagnetan, dan
kekentalan.
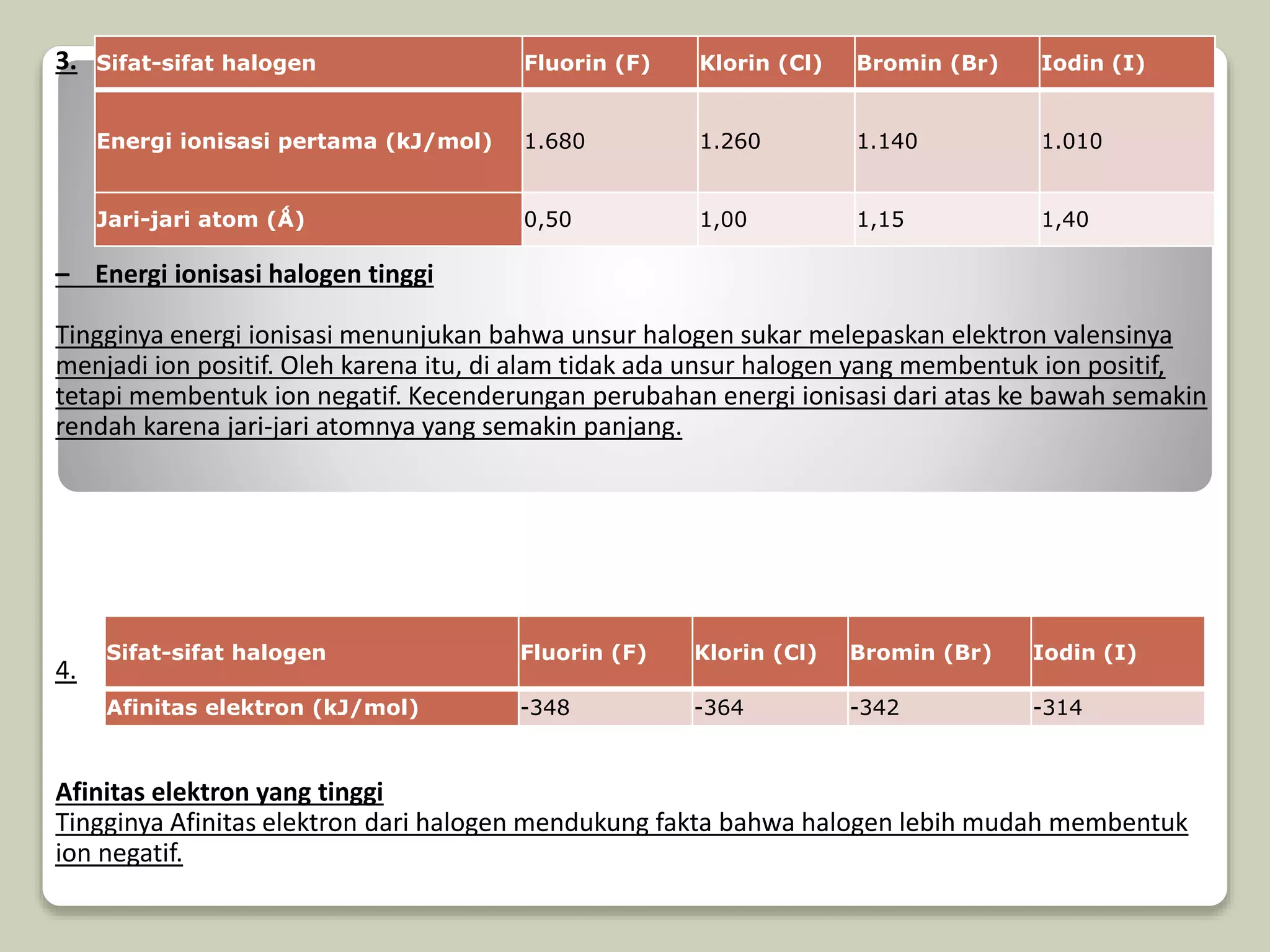
Sifat-sifat halogen Fluorin (F) Klorin (Cl) Bromin (Br) Iodin (I)
Konfigurasi elektron [He] 2s2 2p5 [Ne] 3s2 3p5 [Ar] 3d10 4s2 4p5 [Kr] 4d10 5s2 5p5
Nomor Atom 9 17 35 53
Titik leleh ( ) -220 -101 -7,2 114
Titik didih ( ) -188 -35 59 184
Energi ionisasi pertama (kJ/mol) 1.680 1.260 1.140 1.010
Afinitas elektron (kJ/mol) -348 -364 -342 -314
Keelektronegatifan 4,0 3,0 2,8 2,5
Jari-jari atom (Ǻ) 0,50 1,00 1,15 1,40
Energi ikatan X-X (kJ/mol) 158 242 193 151
Energi ikatan H-X (kJ/mol) 562 431 366 299
Potensial elektrode (volt)
X2 + 2eˉ 2Xˉ
+2,87 +1,36 +1,07 +0,54
Kerapatan (g/mL) 1,0 1,5 3,1 4,9](https://image.slidesharecdn.com/halogen-171217142000/75/Halogen-unsur-golongan-VII-A-6-2048.jpg)
![1.
Konfigurasi elektron valiensi halogen adalah ns2 np5
Adanya sebuah elektron yang tidak berpasangan dapat digunakan untuk membentuk pasangan elektron
bersama dengan sebuah elektron pada subkulit p dari atom halogen yang lain, sehingga halogen dalam
keadaan bebas merupakan molekul diatomik (X2).
2.
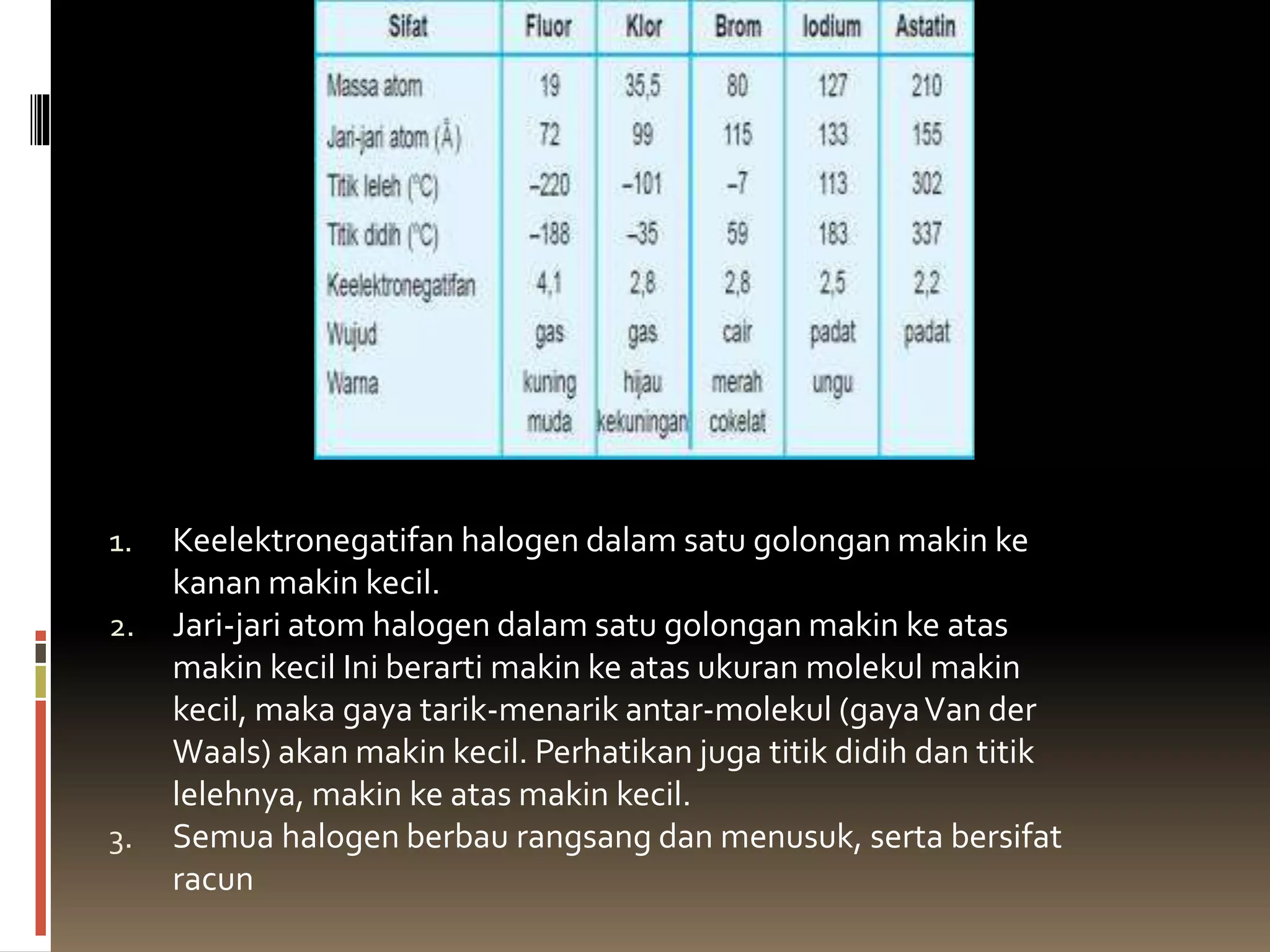
Dari F ke At nomor atom,titik didih dan titik lelehnya semakin tinggi.
Hal ini dapat dijelaskan dengan gaya van der Waals yang bekerja pada molekul-molekul tersebut. Dari atas
(F) ke bawah (At) ukuran atomnya semakin besar sehingga semakin mudah terjadi dipol sesaat yang
berakibat semakin kuatnya gaya van der Waals. Semakin kuat gaya van der Waals, semakin tinggi titik didih
dan titik lelehnya.
Sifat-sifat halogen Fluorin (F) Klorin (Cl) Bromin (Br) Iodin (I)
Nomor Atom 9 17 35 53
Titik leleh ( ) -220 -101 -7,2 114
Titik didih ( ) -188 -35 59 184
Sifat-sifat halogen Fluorin (F) Klorin (Cl) Bromin (Br) Iodin (I)
Konfigurasi elektron [He] 2s2 2p5 [Ne] 3s2 3p5 [Ar] 3d10 4s2 4p5 [Kr] 4d10 5s2 5p5](https://image.slidesharecdn.com/halogen-171217142000/75/Halogen-unsur-golongan-VII-A-7-2048.jpg)