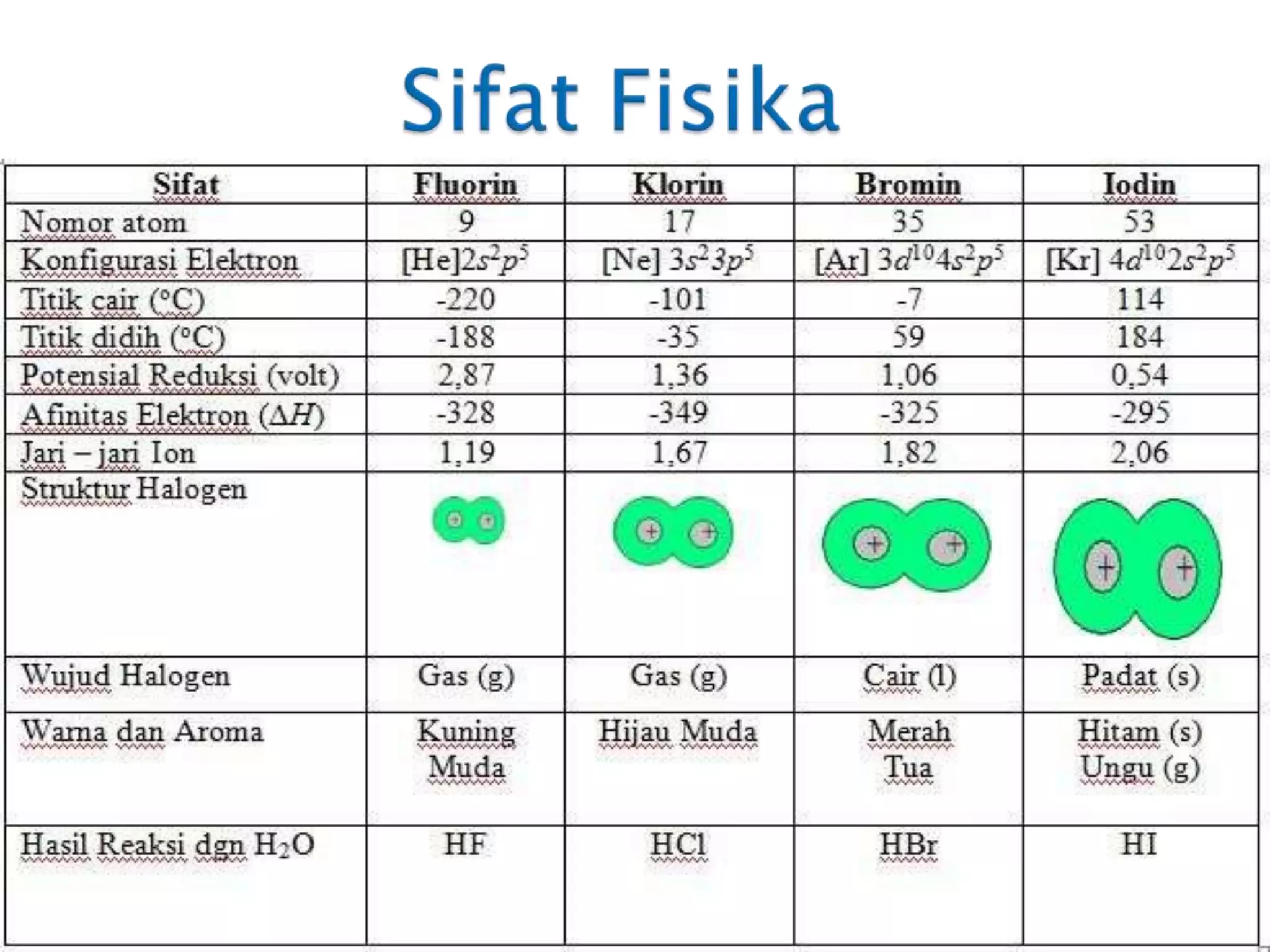
Dokumen ini menjelaskan tentang unsur-unsur halogen dalam sistem periodik, termasuk sifat kimia dan fisika, serta reaktivitasnya. Halogen bersifat reaktif, memiliki warna dan bau khas, serta digunakan dalam berbagai senyawa dan aplikasi industri. Selain itu, dokumen ini juga membahas reaksi dengan air, logam, non-logam, dan penggunaan praktis dari unsur-unsur tersebut.