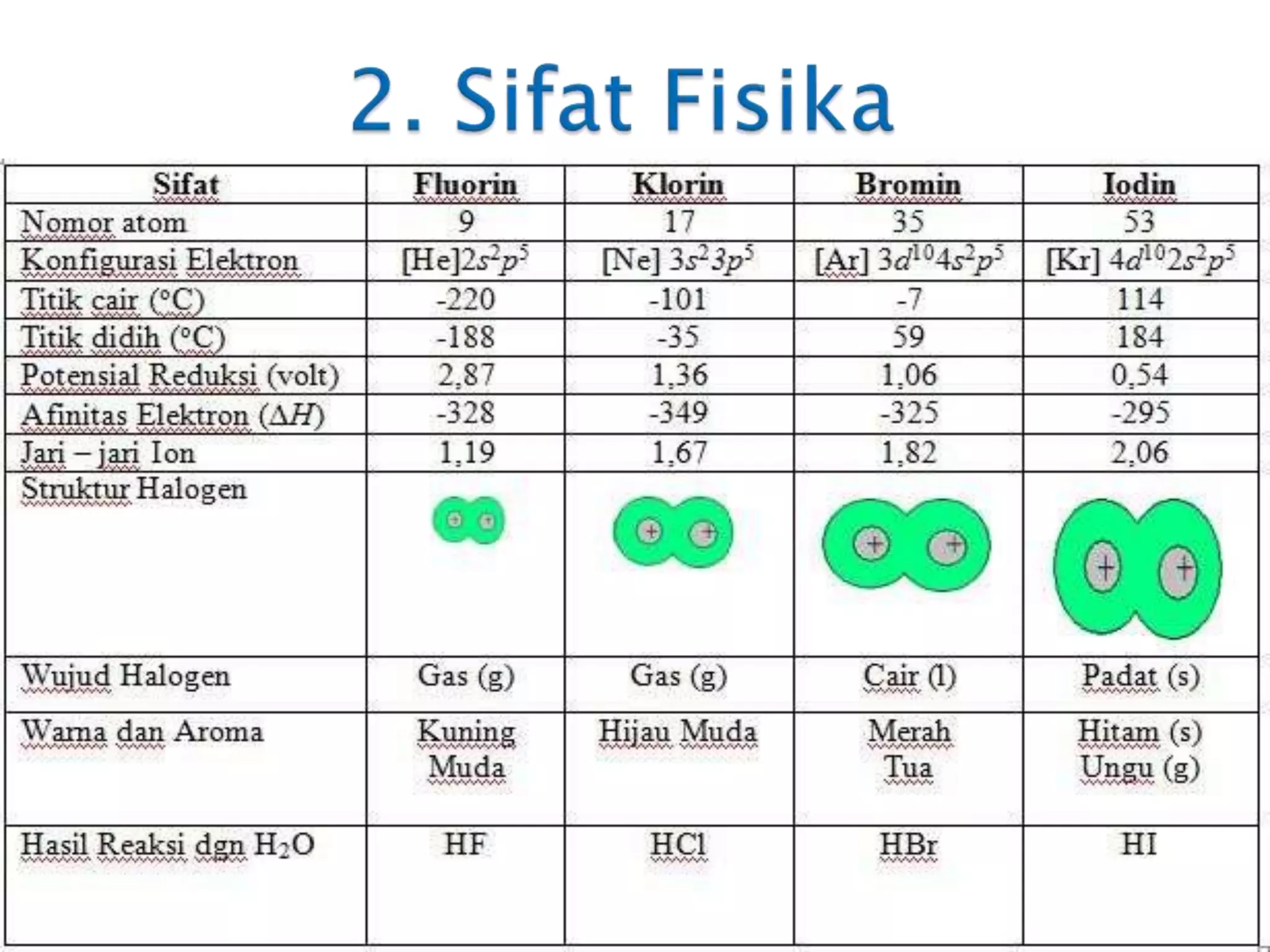
Dokumen ini membahas tentang unsur halogen dalam sistem periodik, mencakup sifat-sifat fisika dan kimia dari unsur-unsur tersebut seperti energi ionisasi, afinitas elektron, dan daya reaksi. Halogen memiliki karakteristik reaktivitas yang menurun dari atas ke bawah golongan, dan digunakan dalam berbagai aplikasi industri dan kesehatan. Selain itu, reaksi-reaksi halogen dengan berbagai senyawa serta dampak penggunaannya, seperti pada lapisan ozon, juga dijelaskan.