More Related Content
PDF
ชุดกิจกรรมการเรียนรู้ เรื่องอัตราการเกิดปฏิกิริยาเคมี PDF
เอกสารประกอบการเรียนเรื่องเสียงกับการได้ยิน ป.5 PDF
ใบความรู้เรื่องเซลล์ของสิ่งมีชีวิต1 PDF
PDF
แบบทดสอบ เรืื่องพอลิเมอร์ PDF
PDF
การเปลี่ยนแปลงพลังงานและการเกิดปฏิกิริยาเคมี PDF
What's hot
PDF
วิทยาศาสตร์กายภาพ 1 เรื่อง อาหาร PDF
7.ชุดที่ 4 การสังเคราะห์แสง PDF
PDF
ใบความรู้ที่ 1 สภาพขั้วของโมเลกุลโคเวเลนต์ PDF
PDF
03แบบฝึกกฎการอนุรักษ์พลังงานกล PDF
สารประกอบไฮโดรคาร์บอนเคน คีน ไคน์ PPT
PDF
PDF
1 ความหมายอัตราการเกิดปฏิกิริยาเคมี PDF
PDF
ใบงานที่ 2 การจัดเรียงอิเล็กตรอน PDF
แบบทดสอบ วิทยาศาสตร์ 2 ชั้น ม.1 ชุดที่ 2 PDF
PDF
PDF
เอกสารประกอบการสอน อวัยวะรับสัมผัส PDF
ทฤษฎีและพลังงานกับการเกิดปฏิกิริยาเคมี PDF
PDF
PDF
แบบรายงานการแสดงทางวิทยาศาสตร์ Similar to กระบวนการอิเล็กโทรลิซิส (Electrolysis Chemistry)
PDF
PPT
PPT
PPT
PDF
วิชาเคมี มัธยมปลาย เรื่องปฏิกริยาไฟฟ้าเคมี PDF
PPT
PPT
PPT
PPT
PDF
เคมีไฟฟ้า (Electrochemistry) DOC
PPTX
PDF
PDF
PDF
DOC
PPS
PPTX
ประโยชน์ของอิเล็กโทรไลซิส DOC
กระบวนการอิเล็กโทรลิซิส (Electrolysis Chemistry)
- 2.
ทบทวน เซลล์ไฟฟ้าเคมีแบ่งออกได้เป็น 2ชนิด คือ
1. เซลล์กัลวานิก(Galvanic cell)
2. เซลล์อิเล็กโทรไลติก(Electrolytic cell)
ปฏิกิริยาเคมี → กระแสไฟฟ้า
กระแสไฟฟ้า → ปฏิกิริยาเคมี
เรียกกระบวนการที่เกิดขึ้นในเซลล์ว่า กระบวการอิเล็กโทรลิซิส
- 3.
- 4.
- 5.
- 7.
- 8.
- 9.
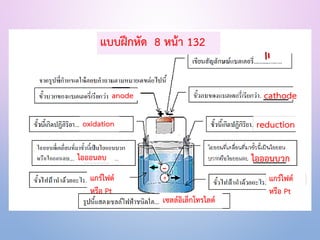
ตัวอย่าง การแยก CaCl2ที่หลอมเหลวด้วยกระแสไฟฟ้า
Anode (ออกซิเดชัน) : 2 Cl− Cl2(g)+ 2e–
Cathode (รีดักชัน) : Ca 2+ + 2e– Ca(l)
ปฏิกิริยารวม : 2 Cl− + Ca 2+ Cl2(g) + Ca(l)
- 10.
- 11.
- 12.
K+ (l) +e- -----> K (l) 2I− (l) -----> I2 (g) + 2e-
2K+ + 2I− (l) -----> 2K(l) + I2 (g)
oxidation
reduction
K+
K (l)
I−
I2
- 13.
- 14.
- 15.
- 17.
แอโนด (ขั้วที่ต่ออยู่กับขั้วบวกของแบตเตอรี)
ในสารละลายมี SO4
2-และ H2O ที่มีโอกาสให้อิเล็กตรอนหรือเกิดปฏิกิริยาออกซิเดชัน แต่ค่า EO
ของสองครึ่งปฏิกิริยาเป็นดังนี้
½ S2O8
2-(aq) + e– → SO4
2-(aq) EO = +2.01 V
1/2O2(g) + 2H+(aq) + 2e– → H2O(l) EO = +1.23 V
กลับสมการให้ เป็นปฏิกิริยาออกซิเดชัน เพื่อให้สอดคล้องกับปฏิกิริยาที่จะเกิดขึ้นที่
แอโนด ดังนี้
H2O(l) → 1/2 O2(g) + 2H+(aq) + 2e– EO = –1.23 V
Eo น้อย
เกิดดีกว่า
- 19.
ถึงแม้ในปฏิกิริยาจะมี H+ เกิดขึ้นด้วยและอาจรับอิเล็กตรอนเกิดเป็นแก๊ส H2 แต่เมื่อ
เปรียบเทียบค่า EO จากครึ่งปฏิกิริยาต่อไปนี้
Cu2+(aq) + 2e– → Cu(s) EO = +0.34 V
2H+(aq) + 2e– → H2(aq) EO= 0.00 V
เกิดดีกว่า
สรุป ปฏิกิริยาการแยกสารละลาย CuSO4 ด้วยกระแสไฟฟ้า
แอโนด : H2O(l) → O2(g) + 2H+(aq) + 2e– EO = −1.23 V
แคโทด : Cu2+(aq) + 2e– → Cu(s) EO = + 0.34 V
ปฏิกิริยารวม : Cu 2+(aq) + H2O(l) → Cu (s) + O2(g) + 2H+(aq)
= -0.89 V
o
cell
E
=
–
- 20.
- 21.
- 22.
- 23.
- 24.
- 25.
- 26.
- 27.
1. การผลิตโลหะโซเดียม ใช้อุปกรณ์ที่เรียกว่าDown Cell
อุปกรณ์
1. แหล่งจ่ายไฟ
2. cathode :เหล็ก
anode : แกร์ไฟต์
3. NaCl หลอมเหลว
Anode : 2 Cl− Cl2(g)+ 2e−
Cathode : 2 Na++ 2e − 2Na(l)
ปฏิกิริยารวม : 2 Cl− + 2 Na+ Cl2(g) + 2Na(l)
- 28.
- 29.
4.2 การผลิตโลหะอะลูมิเนียม (กระบวนการฮอล)
วิธีที่1 ถลุงแร่บอกไซต์ด้วยความร้อนแล้วรีดิวซ์ Al2O3 เพื่อให้ได้อะลูมิเนียม แต่
วิธีนี้หาตัวรีดิวซ์ที่เหมาะสมยาก
วิธีที่ 2 แยกด้วยกระแสไฟฟ้า
นาAl2O3 ซึ่งมีจุดหลอมเหลวสูง 2045 OC มาผสมกับแร่ไครโอไลต์ Na3AlF6 ที่
หลอมเหลว จะได้ของผสมหลอมเหลวที่อุณหภูมิต่าลงและนาไฟฟ้าได้ สามารถนาไป
แยกด้วยกระแสไฟฟ้าที่อุณหภูมิประมาณ 1000 OC
ไม่นิยม
- 30.
การผลิตโลหะอะลูมิเนียม (กระบวนการฮอล)
อุปกรณ์
1. แหล่งจ่ายไฟ
2.cathode :แผ่นคาร์บอน
anode : แท่งคาร์บอน
3. Al2O3 ผสม cryolite
Anode : 3O2− 3/2O2(g)+ 6e¯
Cathode : 2Al3++ 6e¯ 2Al(l)
แก๊สออกซิเจนที่เกิดขึ้นจะทาปฏิกิริยากับคาร์บอนที่แอโนด ได้ผลิตภัณฑ์ส่วนใหญ่เป็น CO2
ดังสมการ
C(s) + O2(g) → CO2(g)
ปฏิกิริยารวม : Al2O3(l) + 3C(s)→ Al(l) + CO2(g)
- 31.
- 32.
- 33.
- 34.
Anode : CuCu2+ + 2e-
Fe Fe2+ + 2e-
Zn Zn 2+ + 2e-
Cathode : Cu 2+ + 2e - Cu(บริสุทธิ์99.95%)
- 35.
- 36.