More Related Content
PPT
PDF
PDF
ชุดกิจกรรมการเรียนรู้ เรื่องอัตราการเกิดปฏิกิริยาเคมี PDF
PDF
PDF
PDF
5 ปัจจัยที่มีผลต่ออัตราการเกิดปฏิกิริยาเคมี PDF
ทฤษฎีและพลังงานกับการเกิดปฏิกิริยาเคมี What's hot
PDF
PDF
PDF
เอกสารประกอบการเรียน เคมีอินทรีย์ 2 PDF
PDF
PDF
PDF
วิทยาศาสตร์กายภาพ 1 เรื่อง อาหาร PDF
4 พลังงานกับการดำเนินไปของปฏิกิริยา PDF
PPT
PDF
อัตราการเกิดปฏิกิริยาเคมี PDF
เอกสารประกอบการเรียน เคมีอินทรีย์ 1 PDF
PDF
วิทยาศาสตร์กายภาพ 1 เรื่อง อากาศ PDF
6แบบทดสอบการลำเลียงสารผ่านเซลล์ PDF
ใบความรู้ เรื่อง การทำนายรูปร่างโมเลกุลโคเวเลนต์ PDF
PPTX
PDF
PDF
ติวสบายฟิสิกส์ (เพิ่มเติม) บทที่ 03 แรงกฏการเคลื่อนที่ Similar to ไฟฟ้าเคมี1 ppt
PDF
PDF
PDF
PDF
PDF
PDF
วิชาเคมี มัธยมปลาย เรื่องปฏิกริยาไฟฟ้าเคมี PPS
PPT
PPT
PDF
PDF
PDF
PPT
PDF
เคมีไฟฟ้า (Electrochemistry) PPT
DOC
PPTX
6-ปฏิกิริฟหดฟหกดฟหกดฟหกดฟหกดฟหกดยาเคมี-นร.pptx PPT
บทที่ 4 stoichiometry.ppt DOC
PPT
ไฟฟ้าเคมี1 ppt
- 2.
ไ ฟ ฟ้า เ ค มี คื อ อ ะ ไ ร มี
ความสัมพันธ์กับปฏิกิริยา
รีดอกซ์อย่างไร??
- 3.
- 4.
- 5.
- 6.
- 7.
ออกซิเจนในสารประกอบส่วนใหญ่มีค่าเท่ากับ -2
เช่น CO2,CaO, H2SO4, H2O
เลขออกซิเดชันของไอออนจะมีค่าเท่ากับประจุของ
ไอออนนั้นเช่น Na+ = +1, S2- = -2, Al3+ = +3
SO32- = -2 (S = +4, O = (-2×3) )
NH4+ = +1 ( N = -3, H = 4×(+1) )
ในสารประกอบใดๆผลรวมเลขออกซิเดชันเท่ากับ
ศูนย์ เช่น H2SO4 (+1×2)+(+6)+(-2×4)=0
- 8.
ธาตุหมู่ 1, 2,3 ในสารประกอบต่างๆมีเลข
ออกซิเดชันเท่ากับ +1, +2 และ +3 ตามลาดับ
ธาตุอโลหะ (หมู่ 4, 5, 6, 7) ในสารประกอบ
ต่างๆส่วนใหญ่มีเลขออกซิเดชันได้หลายค่า เช่น Cl
ใน HCl, HClO, HClO2, HClO3, FeCl2 มีเลข
ออกซิเดชันเท่ากับ -1, +1, +3, +5, +2
ธาตุ ท รานซิ ชั น ส่ ว นใหญ่ มี เ ลขออกซิ เ ดชั น ได้
มากกว่าหนึ่งค่า เช่น Fe ใน FeO และ Fe2O3
เท่ากับ +2, +3
- 9.
ตัวอย่าง
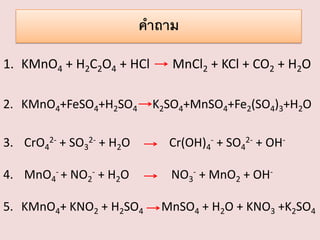
1. หาเลขออกซิเดชันของ Crใน K2CrO4 และ Na2Cr2O7
K2CrO4
2(+1) + Cr + 4(-2) = 0
Cr + (-6) = 0
Cr
= +6
Na2Cr2O7
2(+1) + 2a + 7(-2) = 0
2 + 2a + (-14) = 0
a = 14-2/2 = 6
Cr = +6
- 10.
2. Mn ในMnO42Mn + 4(-2) = -2
Mn = +6
3. Cu ใน Cu(NH3)2Cl3Cu + 2(0) + 3(-1) = -1
Cu = +2
- 11.
- 12.
- 13.
- 14.
+2 +6 -14
+1+7 -8
+1 +5 -6
K2Cr2O7
KMnO4
HClO3
+3 +5 -8
H3PO4
+6 -8
CrO42-
+1 +7 -8
HClO4
+2 +4 -6
+2 +3 -8
+4 +2
Na2SnO3
H2C2O4
K4[Co(CN)6]
+2
-2
Co(NO3)2
-6
- 15.
• ปฏิกิริยารีดอกซ์ (Redoxreaction) เป็นปฏิกิริยาที่ประกอบด้วย
2 ปฏิกิริยาย่อย คือ ปฏิกิริยารีดักชันกับออกซิเดชัน
• ปฏิ กิ ริ ย าออกซิ เ ดชั น หมายถึ ง ปฏิ กิ ริ ย าที่ มี ส ารหนึ่ ง ให้ (เสี ย )
อิเล็กตรอนแล้วมีเลขออกซิเดชันเพิ่มขึ้น เช่น
0
+2
Mg2+ (aq) + 2e-
Mg(s)
O.N. เพิมขึ้น 2
่
- 16.
• ปฏิกิริยารีดักชัน หมายถึงปฏิกิริยาที่สารรับอิเล็กตรอนแล้วมีเลข
ออกซิเดชันลดลง เช่น
+2
+7
MnO4-(aq) + 8H+(aq) + 5eO.N. ลดลง 5
Mn2+ (aq) + 4H2O
- 17.
- 18.
- 19.
ขั้นตอนการทดลอง
1. ใส่สารละลาย CuSO41 mol/dm3 ลงในบีเกอร์ 2 ใบ ใบละ
25 cm3 สังเกตสีของสารละลาย
2. จุ่มโลหะสังกะสีขนาด 0.5 cm × 7 cm และ โลหะทองแดง
ขนาดเดียวกัน ลงในบีกเกอร์ใบที่ 1 และ 2 ตั้งไว้สักครู่
สังเกตการณ์เปลี่ยนแปลงที่เกิดขึ้นทั้งในสารละลายและ
แผ่นโลหะ ถ้ามีสารมาเกาะบนแผ่นโลหะให้ใช้แท่งแก้วเขี่ย
ออก และสังเกตผิวของโลหะอีกครั้ง
- 20.
- 21.
- 22.
- 23.
- 24.
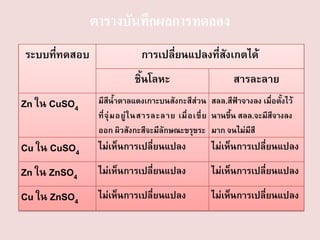
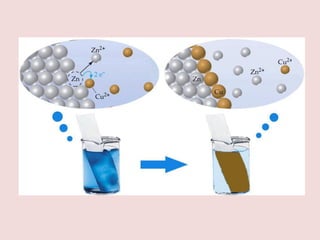
• ระบบที่เกิดปฏิกิริยาได้แก่ จุ่มโลหะZn ลงในสารละลายสีฟ้าของ
CuSO4 จะเกิดสารสีน้าตาลแดงเกาะรอบ ๆ แผ่น Zn ซึ่งสารสี
น้าตาลแดงก็คือโลหะ Cu นั่นเอง ซึ่งเกิดได้โดย Zn เป็นฝ่ายให้
อิเล็กตรอนเปลี่ยนไปเป็น Zn2+ และ Cu2+ รับอิเล็กตรอน
เปลี่ยนไปเป็นโลหะ Cu เกาะที่แผ่น Zn เมื่อปล่อยให้ปฏิกิริยา
ดาเนินไปเรื่อย ๆ จะมีโลหะ Cu เกาะที่แผ่น Zn มากขึ้นเรื่อย ๆ
และแผ่น Zn จะผุกร่อนลงเนื่องจากเปลี่ยนไปเป็น Zn2+ ซึง
่
ละลายน้าได้ สีฟ้าของสารละลายจะจางลงเรื่อย ๆ ปฏิกิริยารวมที่
เกิดขึ้นเป็นดังนี้
Zn(s) + Cu2+ (aq)
Zn2+(s) + Cu(s)
- 26.
• ปฏิ กิริ ย า ย่ อ ยที่ เ กิ ด ขึ้ น หรื อ ที่ เ รี ย ก ว่ า ครึ่ ง ปฏิ กิ ริ ย า (halfreaction)
คื อ ปฏิ กิ ริ ย าออกซิ เ ดชั น เป็ น ปฏิ กิ ริ ย าที่ มี ก ารให้
อิเล็กตรอน โดย Zn ให้อิเล็กตรอนแล้วกลายเป็น Zn2+
Zn(s)
Zn2+ (aq) +2e-
ถ้าพิจารณาเลขออกซิเดชันของ Zn เมื่อให้อิเล็กตรอนแล้วมี
เลขออกซิเดชันเพิ่มขึ้นจาก 0 เป็น +2
ปฏิกิริยาออกซิเดชันจึงเป็นปฏิกิริยาที่มีการเพิ่มขึ้นของเลข
ออกซิเดชัน และอาจกล่าวว่า สารที่สูญเสียอิเล็กตรอนและเลข
ออกซิเดชันเพิ่มขึ้น (Zn) นีถูกออกซิไดซ์
้
- 27.
• ปฏิกิริยารีดักชัน เป็นปฏิกิริยาที่มีการรับอิเล็กตรอนโดย Cu2+ รับ
อิเล็กตรอนแล้วกลายเป็นอะตอมของ Cu
Cu2+ (aq) + 2e-
Cu(s)
Cu2+ เมื่อรับอิเล็กตรอนแล้วมีเลขออกซิเดชันลดลงจาก +2
เป็น 0 ปฏิกิริยารีดักชันจึง
เป็นปฏิกิริยาที่มีการลดลงของเลขออกซิเดชัน และอาจกล่าว
ว่า สารที่รับอิเล็กตรอนและมีเลขออกซิเดชันลดลง (Cu2+) นีถูก
้
รีดิวซ์
- 28.
จากการทดลองที่ 9.1
จะพบว่ าในระบบที่ จุ่ ม
โลหะทองแดงลงในสารละลาย ZnSO4 พบว่าไม่มีการ
เปลี่ ย นแปลงเกิ ด ขึ้ น แสดงว่ า โลหะทองแดงไม่ ใ ห้
อิเล็ก ตรอนแก่ Zn2+ หรื ออาจกล่ าวว่ า Zn2+ ไม่
สามารถรับอิเล็กตรอนจากโลหะทองแดงได้
- 29.
- 30.
- 31.
ปฏิกิริยาที่สารให้อิเล็กตรอน เรียกว่า ปฏิกิริยาออกซิเดชันส่วน
ปฏิกิริยาที่สารรับอิเล็กตรอนเรียกว่า ปฏิกิริยารีดักชัน
ปฏิกิริยาออกซิเดชันและรีดักชันจัดเป็นครึ่งปฏิกิริยา รวม
เรียกว่า ปฏิกิริยารีดอกซ์
สารที่ให้อิเล็กตรอน เรียกว่า ตัวรีดิวซ์
สารที่รับอิเล็กตรอน เรียกว่า ตัวออกซิไดซ์
สารที่เสียอิเล็กตรอนไป เรียกว่า ถูกออกซิไดซ์
สารที่ได้อิเล็กตรอนมา เรียกว่า ตัวรีดิวซ์
- 32.
- 33.
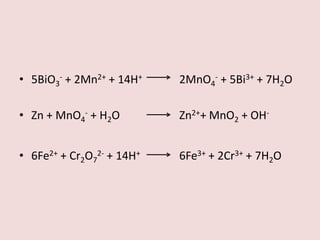
• 5BiO3- +2Mn2+ + 14H+
2MnO4- + 5Bi3+ + 7H2O
• Zn + MnO4- + H2O
Zn2++ MnO2 + OH-
• 6Fe2+ + Cr2O72- + 14H+
6Fe3+ + 2Cr3+ + 7H2O
- 34.
- 35.
- 36.
การดุลสมการโดยใช้เลข
ออกซิเดชัน
• หลักการสาคัญ คือทาให้เลขออกซิเดชัน
ของธาตุหรือไอออนที่เพิ่มขึ้นให้เท่ากับเลข
ออกซิเดชันของธาตุที่ลดลง จากนั้นดุล
อะตอมอื่นที่เลขออกซิเดชันไม่เปลี่ยนแปลง
• ตรวจความถูกต้องโดย นับจานวนอะตอมของ
ธาตุและประจุไฟฟ้าทั้งสารตั้งต้นและ
ผลิตภัณฑ์จะต้องเท่ากัน
- 37.
- 38.
- 39.
• สารตั้ งต้ น ในปฏิ กิ ริ ย านี้ ไ ด้ แ ก่ โลหะอะลู มิ เ นี ย ม (Al) และ
สารละลายZn2+ ส่วนผลิตภัณฑ์ที่เกิดอะลูมิเนียมกร่อนไปแสดง
ว่ า โลหะอะลู มิ เ นี ย มให้ อิ เ ล็ ก ตรอนเกิ ด เป็ น Al3+ ส่ ว นใน
สารละลายซึ่งมี Zn2+ ละลายอยู่จึงรับอิเล็กตรอนเกิดเป็นโลหะ
สังกะสี(Zn) เขียนสมการได้ดังนี้
Al(s) + Zn2+ (aq)
Al3+ + Zn(s)
- 40.
• ขั้นที่ 1หาเลขออกซิเดชันของธาตุหรือไอออนในปฏิกิริยาเพื่อให้ทราบ
ตัวรีดิวซ์และตัวออกซิไดซ์
Al(s) + Zn2+ (aq)
Al3+ + Zn(s)
0
+3
+2
0
• ขั้นที่ 2 หาเลขออกซิเดชันที่เพิ่มขึ้นของตัวรีดิวซ์และเลขออกซิเดชันที่
ลดลงของตัวออกซิไดซ์ ดังนี้
ตัวรีดิวซ์ O.N. เพิ่มขึน 3
้
Al(s) + Zn2+ (aq)
ตัวออกซิไดซ์ O.N. ลดลง 2
Al3+ + Zn(s)
- 41.
• ขั้นที่ 3ทาเลขออกซิเดชันของตัวรีดิวซ์และตัวออกซิไดซ์ให้เท่ากัน โดย
เติม 2 หน้า Al(s) กับ Al3+ (aq) และเติม 3 หน้า Zn2+ (aq) กับ
Zn(s)
ตัวรีดิวซ์ เพิ่มขึ้น (2)×3 = 6
2Al(s) + 3Zn2+ (aq)
2Al3+ + 3Zn(s)
ตัวออกซิไดซ์ ลดลง (3)×2 = 6
- 42.
• ขั้นที่ 4ตรวจสอบจานวนอะตอมของแต่ละธาตุและผลรวมประจุไฟฟ้า
ของสารตั้งต้นกับผลิตภัณฑ์ให้เท่ากัน
2Al(s) + 3Zn2+ (aq)
ประจุไฟฟ้า
ผลรวมประจุไฟฟ้า
0
3(+2)
6+
2Al3+ + 3Zn(s)
2(+3)
6+
0
- 43.
- 44.
เฉลย
3Sn(s) + 2Cr3+(aq)
3Sn2+ (aq) + 2Cr(s)
Ca(s) + 2Li+ (aq)
Ca2+ (aq) + 2Li(s)
2Fe3+ (aq)+ 2I-(aq)
2Fe2+ (aq) + I2(aq)
2FeCl3 + SnCl2
2FeCl2 + SnCl4
- 45.
- 46.
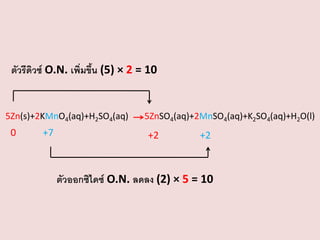
ตัวรีดิวซ์ O.N. เพิ่มขึน(5) × 2 = 10
้
5Zn(s)+2KMnO4(aq)+H2SO4(aq)
0
+7
5ZnSO4(aq)+2MnSO4(aq)+K2SO4(aq)+H2O(l)
+2
+2
ตัวออกซิไดซ์ O.N. ลดลง (2) × 5 = 10
- 47.
• ขั้นที่ 3ดุลจานวนอะตอมที่เลขออกซิเดชันไม่เปลี่ยน ในที่นี้คือ H O
และ S เพื่อความสะดวกให้ดุลเป็นกลุ่ม ดังนี้
1. ดุลหมู่ SO42- โดยเติม 8 หน้า H2SO4
2. ดุลจานวนอะตอมของ O และ H โดยเติม 8 หน้า H2O
5Zn(s)+2KMnO4(aq)+8H2SO4(aq)
5ZnSO4(aq)+2MnSO4(aq)+K2SO4(aq)+8H2O(l)
• ขั้นที่ 4 ตรวจสอบจานวนอะตอมของแต่ละธาตุและผลรวมประจุไฟฟ้า
ของสารตั้งต้นกับผลิตภัณฑ์ให้เท่ากัน
- 48.
- 49.
สรุปวิธีดุลสมการโดยใช้เลขออกซิเดชัน
• ขั้นที่ 1หาเลขออกซิเดชันของธาตุหรือไอออนในปฏิกิริยาเพื่อให้
ทราบตัวรีดิวซ์และตัวออกซิไดซ์
• ขั้นที่ 2 ดุลจานวนอะตอมที่มีเลขออกซิเดชันเปลี่ยนแปลง
• ขั้นที่ 3 ทาผลรวมของเลขออกซิเดชันที่เพิ่มขึ้นและลดลงให้เท่ากัน
• ขั้นที่ 4 ดุลจานวนอะตอมของธาตุที่เลขออกซิเดชันไม่เปลี่ยนแปลง
ทั้งสารตั้งต้นและผลิตภัณฑ์ให้เท่ากัน โดยเริ่มจากโมเลกุลใหญ่ก่อน
• ขั้นที่ 5 ตรวจสอบความถูกต้อง
- 50.
- 51.
•
-
ให้นักเรียนแบ่งกลุ่มออกเป็น 5 กลุ่มกลุ่มละ 8 คน
หัวหน้ากลุ่มจับฉลากเลือกข้อ
เขียนลงในกระดาษบรุ๊พ
นาเสนอหน้าชั้นเรียน
ทุกคนในกลุ่มต้องเข้าใจและทาได้ในหัวข้อที่ได้รับในกลุ่ม
จับฉลากโดยการสุ่มคนในกลุ่มออกมานาเสนอ
ให้แต่ละกลุ่มทาฉลาก เขียนเลขที่ลงในฉลาก
- 52.
- 53.
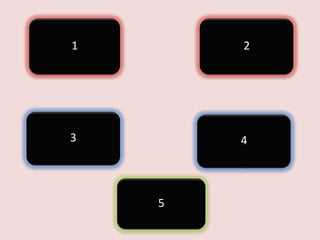
คาถาม
1. KMnO4 +H2C2O4 + HCl
2. KMnO4+FeSO4+H2SO4
MnCl2 + KCl + CO2 + H2O
K2SO4+MnSO4+Fe2(SO4)3+H2O
3. CrO42- + SO32- + H2O
Cr(OH)4- + SO42- + OH-
4. MnO4- + NO2- + H2O
NO3- + MnO2 + OH-
5. KMnO4+ KNO2 + H2SO4
MnSO4 + H2O + KNO3 +K2SO4








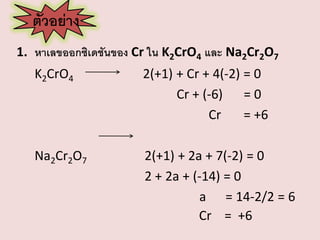
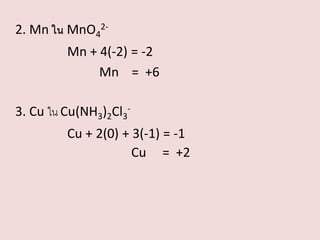

![จงหาเลขออกซิเดชันของธาตุที่ขีดเส้นใต้
[Co(CN)4]4-
[Ni(CN)5]3-
Na2FeO4
Na2ZnO2
CuSO4
Mg(OH)2
H4IO6-
KIO2
S2O32-
S2O82-
K2MnO4
K2CrO4
K2Cr2O7
KMnO4
HClO3
H3PO4
CrO42-
HClO4
Na2SnO3
H2C2O4
K4[Co(CN)6]
Co(NO3)2](https://image.slidesharecdn.com/1ppt-131031020537-phpapp01/85/1-ppt-12-320.jpg)
![0
-4
+2
-5
+2 +6 -8
[Co(CN)4]4-
[Ni(CN)5]3-
Na2FeO4
+2 +1 -4
+2 -2
+2
Na2ZnO-2
CuSO4
Mg(OH)2
+4 +7 -12
+1 +3-4
H4IO6-
KIO2
+7 -16
S2O82-
-2
+2 -6
S2O32-
+2 +6 -8
+2 +6 -8
K2MnO4
K2CrO4](https://image.slidesharecdn.com/1ppt-131031020537-phpapp01/85/1-ppt-13-320.jpg)
![+2 +6 -14
+1 +7 -8
+1 +5 -6
K2Cr2O7
KMnO4
HClO3
+3 +5 -8
H3PO4
+6 -8
CrO42-
+1 +7 -8
HClO4
+2 +4 -6
+2 +3 -8
+4 +2
Na2SnO3
H2C2O4
K4[Co(CN)6]
+2
-2
Co(NO3)2
-6](https://image.slidesharecdn.com/1ppt-131031020537-phpapp01/85/1-ppt-14-320.jpg)