Dokumen ini menjelaskan sifat asam dan basa, definisi Arrhenius dan Brønsted-Lowry, serta konsep pasangan asam-basa konjugat. Selain itu, dijelaskan juga mengenai sifat amfoter, kekuatan asam, dan efek ion senama pada larutan buffer. Terdapat contoh perhitungan konsentrasi ion dan pH pada berbagai larutan asam dan basa.







![Sifat Autoionisasi Air
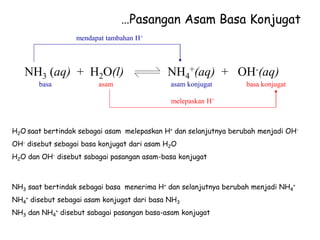
H2O(l) + H2O(l) H3O+(aq) + OH-(aq)
Konstanta kesetimbangan air: Kw
Kw = [H3O+][OH-]
Dimana, [H3O+] = [OH-] = 1,0 x10-7 M
Kw = [H3O+][OH-]
= (1,0 x10-7 M) (1,0 x10-7 M)
= (1,0 x10-14 M)
Berlaku pada suhu 25oC](https://image.slidesharecdn.com/asambasadangaramx-221228133539-1c30f5b5/85/Asam-Basa-dan-Garam-X-ppt-8-320.jpg)



![Skala pH
pH = - log [H3O+] Nilai pH akan semakin
kecil jika konsentrasi
H+ semakin besar
pH menunjukankan tingkat keasaman, batas nilai pH adalah dari 0 sampai 14
Contoh:
Suatu sampel juice lemon memiliki [H+]
sebesar 3,8 x 10-4 M, berapa pH sampel
juice tersebut ?
Jawab:
pH = - log [H+]
= - log (3,8 x 10-4)
= 3,42
Jadi sampel juice apel tersebut memiliki pH 3,42
pH Meter](https://image.slidesharecdn.com/asambasadangaramx-221228133539-1c30f5b5/85/Asam-Basa-dan-Garam-X-ppt-14-320.jpg)

![Asam Lemah
HA(aq) + H2O(l) H3O+(aq) + A-(aq)
HA]
[
]
A
][
O
[H3
a
K
Contoh:
Sampel cuka ditemukan mengandung 0,837 M CH3COOH. Konsentrasi ion
hidronium yang terdapat dalam cuka adalah 3,86 10-3 M. Tentukan Ka untuk
asam asetat.
Penjelasan dan penyelesaian:
Ka untuk asam asetat adalah 1,78 10-5](https://image.slidesharecdn.com/asambasadangaramx-221228133539-1c30f5b5/85/Asam-Basa-dan-Garam-X-ppt-18-320.jpg)
![Contoh Soal
Hitung konsentrasi dari asam yang tidak terionisasi dan ion dari larutan asam
hipoklor (HOCl) 0,10 M dalam keadaan setimbang. Ka HOCl adalah 1,7 x 10 -4
Penjelasan dan penyelesaian:
Maka;
Diketahui:
[HOCl] = 0,10 M
Ka HOCl = 1,74 10-4](https://image.slidesharecdn.com/asambasadangaramx-221228133539-1c30f5b5/85/Asam-Basa-dan-Garam-X-ppt-19-320.jpg)

![Basa Lemah
B(aq) + H2O(l) HB+(aq) + OH-(aq)
B]
[
]
O
][
[HB
b
H
K
Contoh:](https://image.slidesharecdn.com/asambasadangaramx-221228133539-1c30f5b5/85/Asam-Basa-dan-Garam-X-ppt-21-320.jpg)
![Contoh soal: Tentukan konsentrasi OH-, pH dan persen ionisasi dari
larutan NH3 0,20 M
Penjelasan dan penyelesaian:
Kita dapat mengasumsikan x<<0,20 atau (0,20 –x) 0,20 sehingga;
Maka:
Dan [NH3] terionisasi = x = 1,9 10-3 M
%
95
,
0
%
100
20
,
0
10
9
,
1
%
100
]
[NH
]
[NH
si
terionisa
%
3
awal
3
terion
3
Diketahui: [NH3] = 0,20 M](https://image.slidesharecdn.com/asambasadangaramx-221228133539-1c30f5b5/85/Asam-Basa-dan-Garam-X-ppt-22-320.jpg)


![Penjelasan dan penyelesaian:
Diketahui: Reaksi
[NaCH3COO] = 0,20 M
[CH3COOH] = 0,10 M
Konsentrasi
Substitusikan kedalam persamaan konstanta:](https://image.slidesharecdn.com/asambasadangaramx-221228133539-1c30f5b5/85/Asam-Basa-dan-Garam-X-ppt-25-320.jpg)


![...Efek ion senama akan menurunkan pH
Contoh soal: Dengan menggunakan persamaan Henderson–Hasselbalch
Tentukan konsentrasi pH larutan yang mengandung 0,10 M
CH3COOH dan 0,20 M NaCH3COO. Ka CH3COOH = 1,8 10-5
Penjelasan dan penyelesaian:
Diketahui: [NaCH3COO] = 0,20 M
[CH3COOH] = 0,10 M
Konsentrasi
Ka CH3COOH = 1,8 10-5
asam]
[
konjugat]
[basa
p
pH
a
K
Persamaan Henderson–Hasselbalch:](https://image.slidesharecdn.com/asambasadangaramx-221228133539-1c30f5b5/85/Asam-Basa-dan-Garam-X-ppt-28-320.jpg)

![...Efek ion senama dan larutan buffer
2. Larutan basa lemah dengan larutan ion garam dari basa lemah
NH4Cl dan NH3 adalah sumber ion NH4
+
Larutan yang yang mengandung basa lemah dan garam dari basa
lemah akan berkurang kebasaannya dibandingkan dengan basa
lemahnya sendiri
B]
[
]
HB
[
log
p
pOH
b
K](https://image.slidesharecdn.com/asambasadangaramx-221228133539-1c30f5b5/85/Asam-Basa-dan-Garam-X-ppt-30-320.jpg)
![Contoh soal
Tentukan konsentrasi OH- dan pH larutan yang mengandung larutan 0,20 M
NH3 dan 0,10 M NH4Cl.
Reaksi
Penjelasan dan penyelesaian
Diketahui:
[NH4Cl] = 0,10 M
NH3] = 0,20 M
Konsentrasi](https://image.slidesharecdn.com/asambasadangaramx-221228133539-1c30f5b5/85/Asam-Basa-dan-Garam-X-ppt-31-320.jpg)