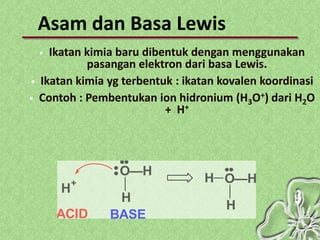
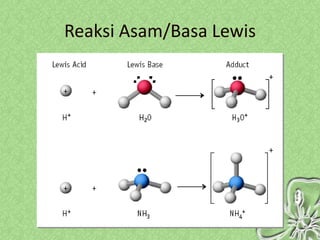
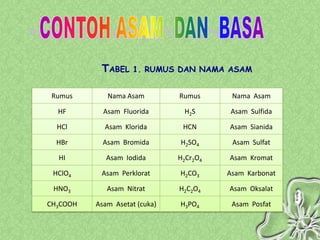
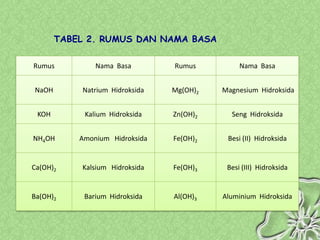
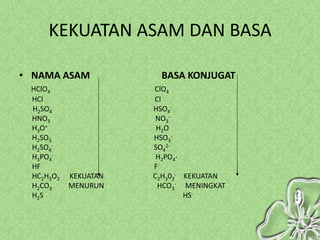
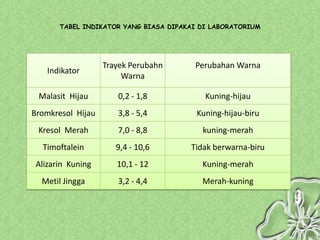
Dokumen ini menjelaskan teori-teori asam basa, termasuk Arrhenius, Bronsted-Lowry, dan Lewis, serta sifat-sifat larutan asam dan basa. Penjelasan mencakup cara menentukan pH larutan dan penggunaan indikator untuk mengidentifikasi asam dan basa. Selain itu, dokumen ini mencakup contoh rumus dan nama-nama asam dan basa serta perhitungan pH berdasarkan konsentrasi larutan.















![1.TETAPAN KESETIMBANGAN AIR
Sebagian kecil dari molekul-molekul air terurai menurut reaksi
kesetimbangan berikut :
H2O H+ + OH-
Kw = [H+] [OH-]
Tetapan kesetimbangan untuk reaksi di atas disebut tetapan
kesetimbangan air (Kw).
C harga Kw = 10-14, berarti dalam air murni (25oC) harga [H+]
= [OH-] = 10-7
Pada suhu 25o](https://image.slidesharecdn.com/asambasa-121213232710-phpapp01/85/Asam-basa-22-320.jpg)
![PH LARUTAN ASAM DAN BASA
Derajat keasaman tergantung pada konsentrasi H+ dan dinyatakan
dalam skala pH.
ASAM LEMAH :
BASA LEMAH :
pH = - Log [H+]
pOH = - Log [OH-]
pKw = pH + pOH = 14
a = valensi asam
b = valensi basa Larutan Asam : pH < 7
M = Molaritas Larutan Netral : pH = 7
Ka = tetapan kesetimbangan asam Larutan Basa : pH > 7
Kb = Tetapan kesetimbangan basa](https://image.slidesharecdn.com/asambasa-121213232710-phpapp01/85/Asam-basa-23-320.jpg)
![Contoh : KESETIMBANGAN
1. Diketahui pH darah manusia 7,41 ASAM
Berapa pOH, [H+], [OH-] ?
pOH :
pH + pOH = 14
7,41 + pOH = 14
pOH = 6,59
[H+] :
pH = - log [H+]
7,41 = - log [H+]
10-7,41 = [H+]= 3,89 x 10-8 M
[OH-] :
pOH = - log [OH-]
6,59 = - log [OH-]
10-6,59 = [OH-] = 2,57 x 10-7 M
Berapa pH pada 0,1 M HNO3
pH = - log [H+]
= - log 0,01
= 1](https://image.slidesharecdn.com/asambasa-121213232710-phpapp01/85/Asam-basa-24-320.jpg)
![KESETIMBANGAN
BASA
Contoh lain :
• HITUNG pH DARI 5,0 X 10-2 NaOH
• JAWAB :
pOH = - log [OH-]
= - log 5,0 x 10-2 = 1,3
pOH + pH = 14
jadi pH = 14 – 1,3
= 12,7](https://image.slidesharecdn.com/asambasa-121213232710-phpapp01/85/Asam-basa-25-320.jpg)
