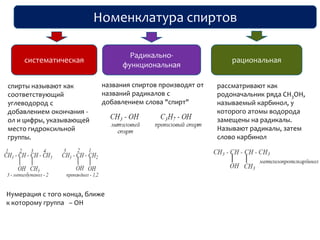
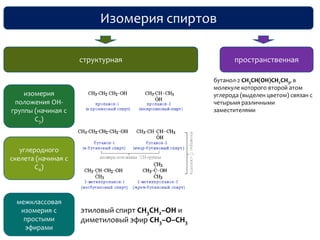
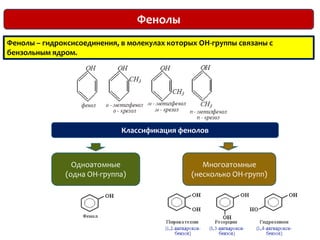
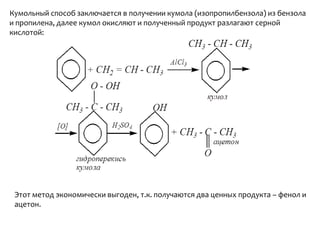
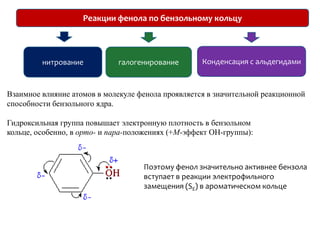
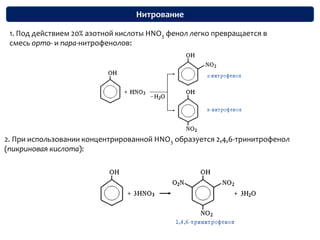
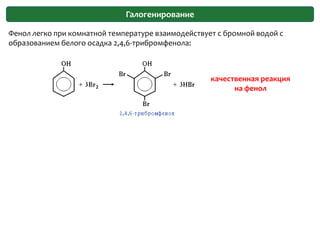
Документ охватывает структуру и свойства гидроксильных соединений, таких как спирты и фенолы, обсуждая их классификацию, номенклатуру и химические реакции. Он также рассматривает физические свойства, кислотность и способы получения гидроксильных соединений, выделяя различия между одноатомными и многоатомными спиртами. Текст акцентирует внимание на реакционной способности спиртов в различных химических процессах и их взаимодействии с другими веществами.