Recommended
PPT
Хімічні властивості металів
PPT
PPT
Кислоти: поняття, назви, склад
PPTX
DOCX
олімпіадні задачі з теми класи неорганічних сполук
PPTX
Презентація до уроку.Лужні метали. Натрій і калій. 10 клас
PPTX
Адаптація до стресу та стресостійкість особистості
PPTX
9 клас повторення з хімії 9 клас pptx
DOCX
завдання на картках 7 клас валентність
PPTX
9 клас урок № 21 лейкоцити
PPT
вуглеводи. глюкоза. сахарозаі
PPT
Додаток 2 Прості речовини Оксигену. Кисень. Озон .ppt
PPT
Силікати. Силикатна промисловість
PPS
оборотні та необоротні реакції. хімічна рівновага
PDF
хімічні рівняння для 7 класу
PPTX
PPT
Фізичні властивості речовин
PPTX
презентація до уроку в 10 класі метали
PPTX
фракційна перегонка нафти
PPTX
PDF
PPTX
PPTX
Загальна будова клітин прокаріот і еукаріот
PPTX
Оксиди Нітрогену та Фосфору
PPT
Оксиди неметалічних елементів
PPT
PPT
PPT
карбон. прості речовини карбону. адсорбція
PPT
DOC
Урок:Фізичні та хімічні властивості оксидів
More Related Content
PPT
Хімічні властивості металів
PPT
PPT
Кислоти: поняття, назви, склад
PPTX
DOCX
олімпіадні задачі з теми класи неорганічних сполук
PPTX
Презентація до уроку.Лужні метали. Натрій і калій. 10 клас
PPTX
Адаптація до стресу та стресостійкість особистості
PPTX
9 клас повторення з хімії 9 клас pptx
What's hot
DOCX
завдання на картках 7 клас валентність
PPTX
9 клас урок № 21 лейкоцити
PPT
вуглеводи. глюкоза. сахарозаі
PPT
Додаток 2 Прості речовини Оксигену. Кисень. Озон .ppt
PPT
Силікати. Силикатна промисловість
PPS
оборотні та необоротні реакції. хімічна рівновага
PDF
хімічні рівняння для 7 класу
PPTX
PPT
Фізичні властивості речовин
PPTX
презентація до уроку в 10 класі метали
PPTX
фракційна перегонка нафти
PPTX
PDF
PPTX
PPTX
Загальна будова клітин прокаріот і еукаріот
PPTX
Оксиди Нітрогену та Фосфору
PPT
Оксиди неметалічних елементів
PPT
PPT
PPT
карбон. прості речовини карбону. адсорбція
Similar to Оксиди Карбону та Силіцію
PPT
DOC
Урок:Фізичні та хімічні властивості оксидів
PPT
алотропні модифікації неметалів
PPT
PPT
Класифікація оксидів. Оксиди в природі, їх використання та фізичні властивості.
PPT
Презентація:Класифікація оксидів. Оксиди в природі, їх використання та фізичн...
PPT
повітря, його склад. оксиген. кисень.
PPS
Презентація:Фізичні та хімічні властивості оксидів:взаємодія з водою, кислота...
PPTX
PPTX
урок хімії в 7 класі оксиген
PDF
PPT
PPTX
PPT
PPTX
Основні класи неорганічних сполук
PPT
хімічні властивості кисню
PPT
Алотропні модифікації неметалів
PPT
хімічні властивості кисню
PPT
PPT
More from Елена Мешкова
PPTX
PPTX
Метан - найпростіший вуглеводень
PPT
Метали в природі. Добування металів
PPT
Елементи-метали. Фізичні властивості металів
PPT
Карбонатна кислота. Карбонати
PPTX
Використання сульфатної кислоти. Сульфати
PPTX
PPT
Промисловий синтез амиаку
PPTX
PPTX
PPTX
PPT
Сполуки неметалів з Гідрогеном
PPTX
Карбон і Силіцій. Вуглець та кремній
PPTX
Приготування розчинів для домедичної допомоги
PPTX
Хімічні властивості азоту та фосфору. Застосування
PPTX
Нітроген і Фосфор. Азот і фосфор як прості речовини
PPTX
Хімічні властивості кисню, озону та сірки. Добування. Використання
PPTX
Оксиген та Сульфур. Алотропні модифікації
PPTX
Процес розчинення. Будова молекули води. Водневий зв'язок
PPT
Загальна характеристика неметалів
Recently uploaded
PPTX
Presentation of the Department of Finance 2026.pptx
PPTX
«Слова і кулі». Письменники, що захищають Україну. Артем Полежака
PPTX
Виставка однієї книги «Незаживаюча рана Афгану: нашим землякам-вінничанам, як...
PPT
Арткалендар. Лютий. Ювіляри у царині світового мистецтва
PPTX
Володимир Владко: втілення людської мрії
PDF
«Микола Івасюк – мистецтва невмирущий птах…» : інформаційно-бібліографічний н...
PPTX
Віртуальна виставка «Ринок аграрної продукції: виклики та перспективи розвитку»
PPTX
Metodichni-rekomendaciyi-MON-shodo-filtraciyi-internet-kontentu-v-zakladah-os...
PDF
Моніт 1.16.pdfМоніт 1.16.pdfМоніт 1.16.pdfМоніт 1.16.pdfМоніт 1.16.pdf
PPTX
Портфоліо Стовповець Людмила Василівна.pptx
PPTX
Інноваційний науково-освітньо-виробничий Кластер «Облік і фінанси в управлінн...
Оксиди Карбону та Силіцію 1. 2. Оксиди Карбону
СО
Безбарвний газ
Без запаху
Надзвичайно
отруйний
СО2
Безбарвний газ
Важчий за повітря
На підтримує горіння та
дихання
Зріджується при кімнатній
температурі і тиску 6МПа
Твердий СО2 називають
“сухим льодом”
3. 4. Порівняння хімічних властивостей
СО СО2
Взаємодія з киснем
Кислотні
властивості
Відновні
властивості
Окисні властивості
OHCHHCO cattp
3
,,
22
Горить у кисні:
СО + О2→СО2
Не підтримує горіння
Взаємодіє з основними
оксидами, лугами,
частково з водою
СО+FeO→Fe+CO2
CO2 + Mg → C + MgO
(виражені слабко)
Не виявляє
5. SiO2 – кремнезем
Кристалічний кремнезем – різновиди
кварцу
Гірський кришталь
Халцедон
Агат
Яшма
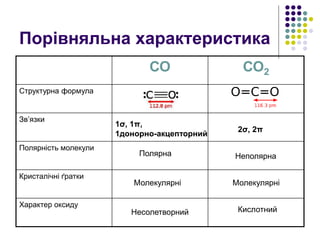
6. 7. Порівняння властивостей CO2 і SiO2
CO2 SiO2
Структурна
формула
Зв’язки
Кристалічні
ґратки
Агрегатний стан
2σ, 2π
Ковалентні полярні
σ-зв’язки
Ковалентні полярні
Молекулярні Атомні
Газ Тверда речовина
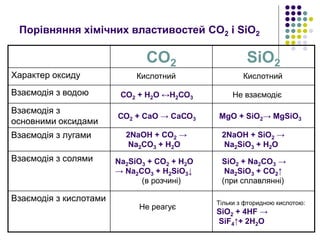
8. Порівняння хімічних властивостей CO2 і SiO2
CO2 SiO2
Характер оксиду
Взаємодія з водою
Взаємодія з
основними оксидами
Взаємодія з лугами
Взаємодія з солями
Взаємодія з кислотами
Кислотний Кислотний
СО2 + Н2О ↔Н2СО3 Не взаємодіє
СО2 + СаО → СаСО3 MgO + SiO2→ MgSiO3
2NaOH + CO2 →
Na2CO3 + H2O
2NaOH + SiO2 →
Na2SiO3 + H2O
Na2SiO3 + CO2 + H2O
→ Na2CO3 + H2SiO3↓
(в розчині)
SiO2 + Na2CO3 →
Na2SiO3 + CO2↑
(при сплавлянні)
Не реагує
Тільки з фторидною кислотою:
SiO2 + 4HF →
SiF4↑+ 2H2O
9. 10. Оксиди Карбону і довкілля
Парниковий
ефект
СО2 здатний
поглинати
ІЧ-промені і
затримувати
частину теплоти
на Землі
11. СО – токсична речовина
СО утворює з
гемоглобіном сполуку,
міцнішу, ніж з киснем.
Тому при наявності в
приміщені чадного
газу наступає задуха і
смерть
12.