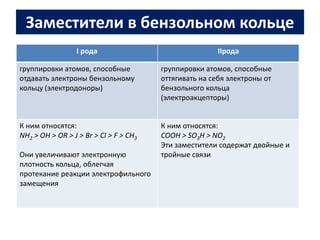
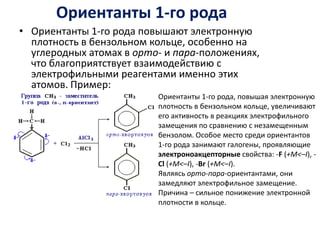
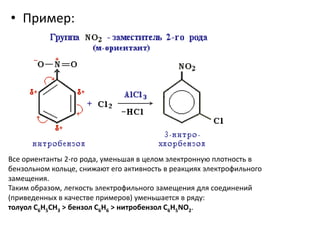
Ароматические углеводороды, или арены, содержат бензольные кольца и характеризуются уникальной π-электронной системой, что делает их устойчивыми к окислению и подверженными реакциям замещения и химическим реакциям, таким как гидрирование и галогенирование. Положение заместителей в бензольном кольце определяется природой уже имеющихся заместителей, а физические свойства аренов зависят от их структуры и наличия боковых цепей. Для изучения реакций аренов важно учитывать ориентацию заместителей и механизмы электрофильного замещения.