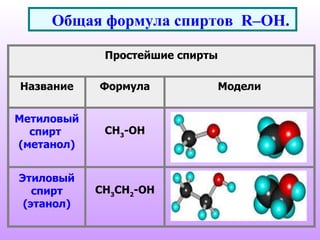
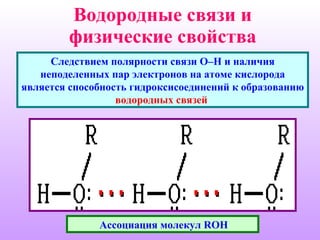
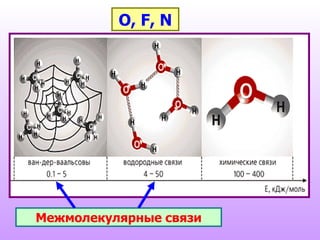
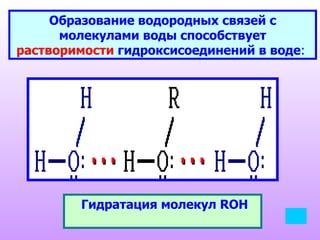
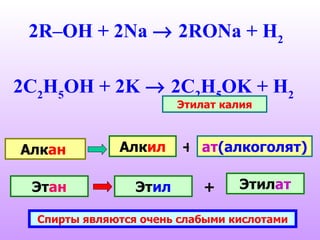
Документ описывает спирты, их классификацию, физические и химические свойства, а также методы получения. Спирты делятся на одноатомные и многоатомные, с приведением примеров, таких как метанол, этанол и глицерин. Обсуждаются реакции спиртов, включая нуклеофильное замещение, окисление и дегидратацию.