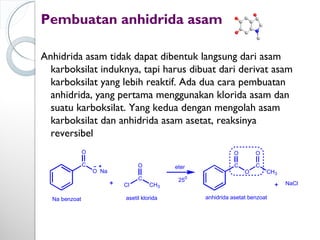
Dokumen ini menjelaskan tentang turunan asam karboksilat, termasuk definisi, karakteristik reaktivitas, serta metode pembuatan dan tatanama untuk halida asam, anhidrida, ester, amida, dan nitril. Setiap jenis turunan memiliki mekanisme reaksi dan kegunaan masing-masing dalam sintesis senyawa organik. Selain itu, reaktivitas turunan asam karboksilat dipengaruhi oleh faktor sterik dan elektronik.