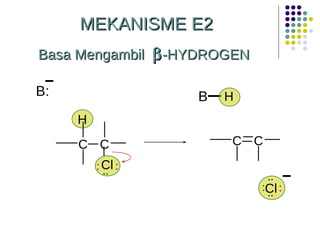
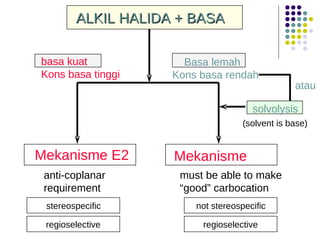
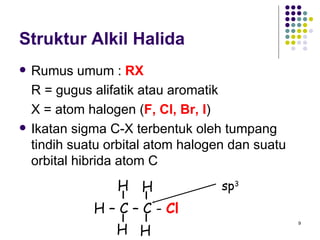
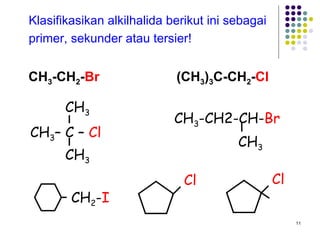
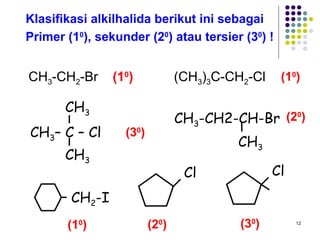
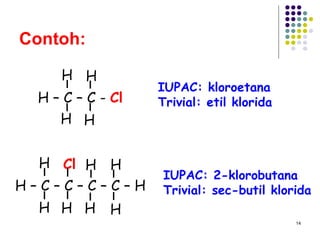
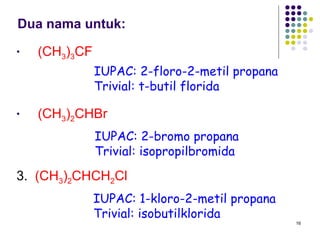
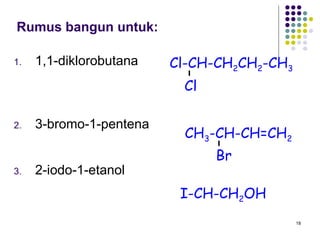
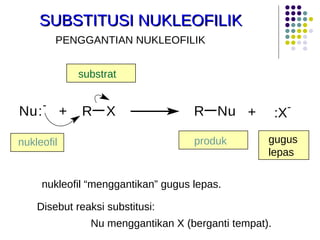
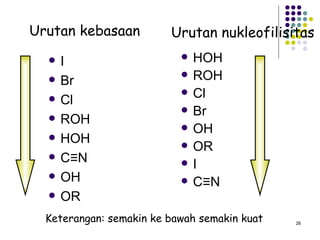
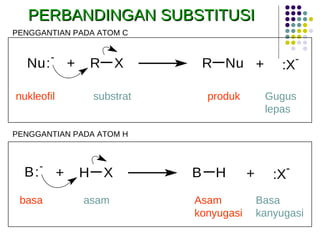
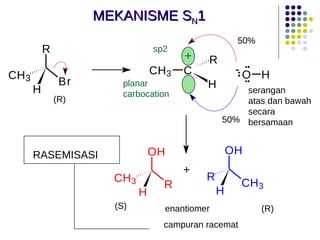
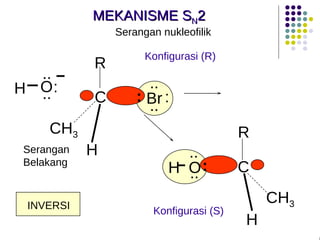
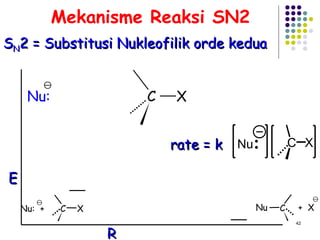
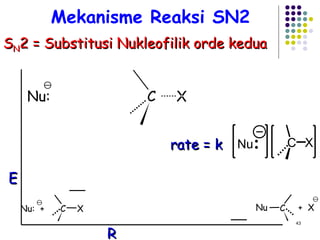
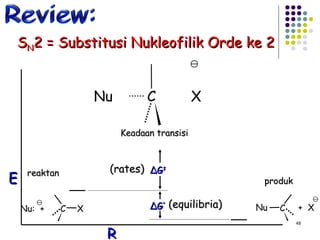
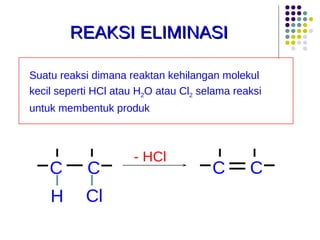
Dokumen ini membahas tentang alkil halida, termasuk jenis-jenisnya, tata nama IUPAC, dan sifat fisik. Selain itu, dokumen ini menjelaskan reaksi substitusi nukleofilik dan eliminasi, serta mekanisme dan klasifikasi reaksi tersebut. Mahasiswa diharapkan dapat memahami penggolongan alkil halida, sifat-sifatnya, serta perbedaan antara nukleofilisitas dan kebasaan.


















![DUA REAKSI MIRIP 1) 2) ( + some alkene by E1,E2 ) 55 o C 55 o C NaOH kons tinggi NaOH kons rendah KEC = k 2 [RBr] [NaOH] KEC = k 1 [RBr] RBr + NaOH ROH + NaBr](https://image.slidesharecdn.com/alkilhalida1-090903010118-phpapp02/85/Alkilhalida-30-320.jpg)
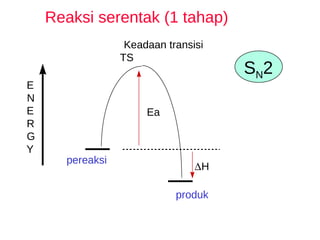
![S N 2 bimolekular 55 o C k 2 = 0.022 liter/mole-sec substitusi nukleofilik bimolekular - kecepatan = k 2 [RBr] [NaOH]](https://image.slidesharecdn.com/alkilhalida1-090903010118-phpapp02/85/Alkilhalida-32-320.jpg)

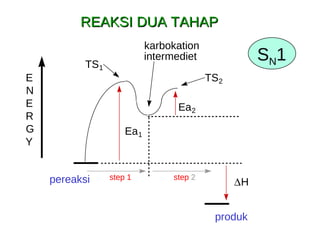
![lambat cepat 2 tahap unimolekular 55 o C k 1 = 0.010 liter/mole-sec substitusi nukleofilik unimolekular alkene (via E1) also kecepatan = k 1 [RBr] S N 1](https://image.slidesharecdn.com/alkilhalida1-090903010118-phpapp02/85/Alkilhalida-35-320.jpg)
![55 o C Alkil halida primer Two similar reactions, different kinetics. RBr + NaOH ROH + NaBr Kecepatan = k 2 [RBr] [NaOH] S N 2 1) Kasus pertama](https://image.slidesharecdn.com/alkilhalida1-090903010118-phpapp02/85/Alkilhalida-37-320.jpg)
![55 o C Alkil halida tersier Kecepatan = k 1 [RBr] S N 1 2) Kasus kedua](https://image.slidesharecdn.com/alkilhalida1-090903010118-phpapp02/85/Alkilhalida-38-320.jpg)

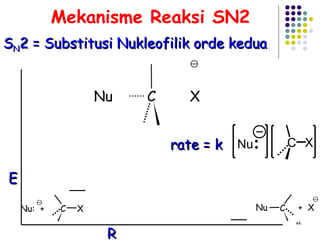
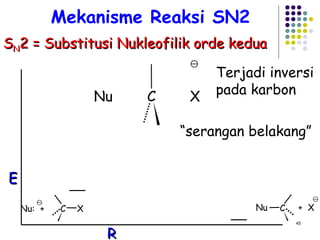
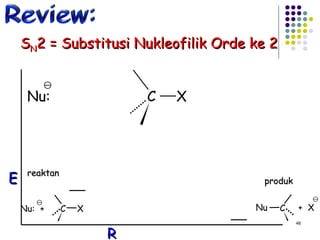
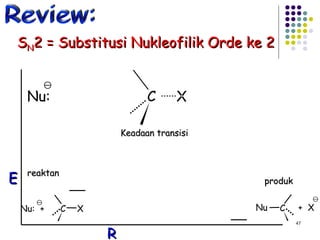

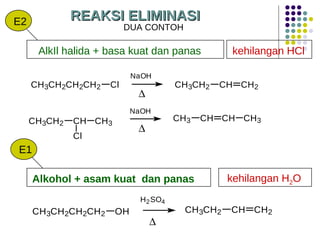
![Reaksi E1 (dua tahap) + slow fast karbokation step one Basa lemah : X Bekerja baik Dalam pelarut Polar kecepatan = k [RX] unimolekular 3 o > 2 o > 1 o step two](https://image.slidesharecdn.com/alkilhalida1-090903010118-phpapp02/85/Alkilhalida-52-320.jpg)