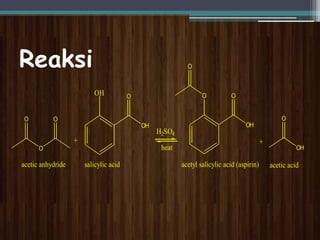
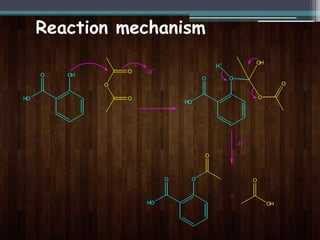
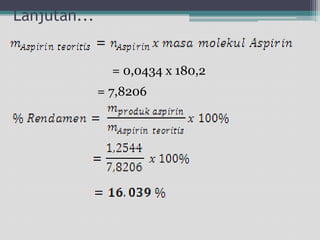
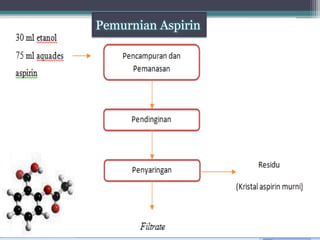
Dokumen ini menjelaskan percobaan sintesis aspirin melalui reaksi asetilasi antara asam salisilat dan anhidrida asetat dengan asam sulfat pekat sebagai katalisator. Aspirin, juga dikenal sebagai asam asetilsalisilat, merupakan obat yang banyak digunakan sebagai penghilang rasa sakit dan dibuat dengan metode yang ditentukan. Selain itu, dokumen ini mencakup sifat fisika dan kimia aspirin serta prosedur untuk menguji kemurnian produk sintesis.