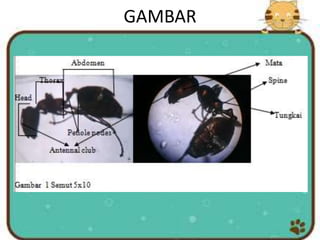
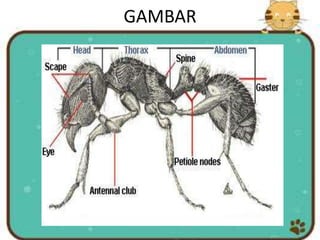
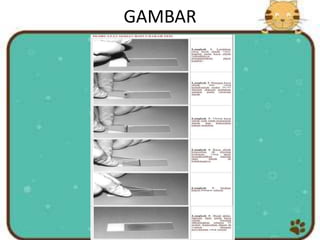
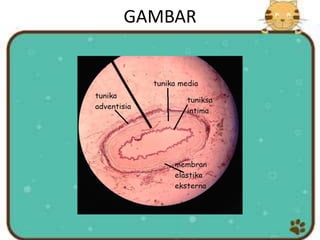
Dokumen ini menjelaskan berbagai metode pembuatan sediaan untuk penelitian di bidang patologi serta langkah-langkah yang diambil untuk mempersiapkan sampel, termasuk metode oles, rentang, pencet, supravital, irisan, dan wholemount. Kelebihan dan kekurangan dari masing-masing metode diuraikan, di samping teknik fiksasi, dehidrasi, dan pengawetan jaringan yang krusial dalam proses mikroskopi. Sediaan apus darah sebagai contoh khusus disebutkan, serta langkah-langkah detail pembuatan dan pewarnaannya agar dapat diapresiasi secara mikroskopis.