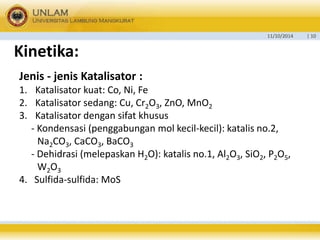
Hidrogenasi adalah proses menggunakan hidrogen untuk mengolah suatu zat, biasanya dengan bantuan katalis. Jenis hidrogenasi meliputi hidrogenasi biasa, hidrogenalisa, dan sintesa hidrokarbon. Hidrogenasi memiliki berbagai manfaat seperti bahan baku minyak tanah dan industri pengolahan minyak nabati atau hewani. Zat yang dapat dihidrogenasi antara lain alkana, olefin, asetilen, karbohidrat, senyawa aromatik,