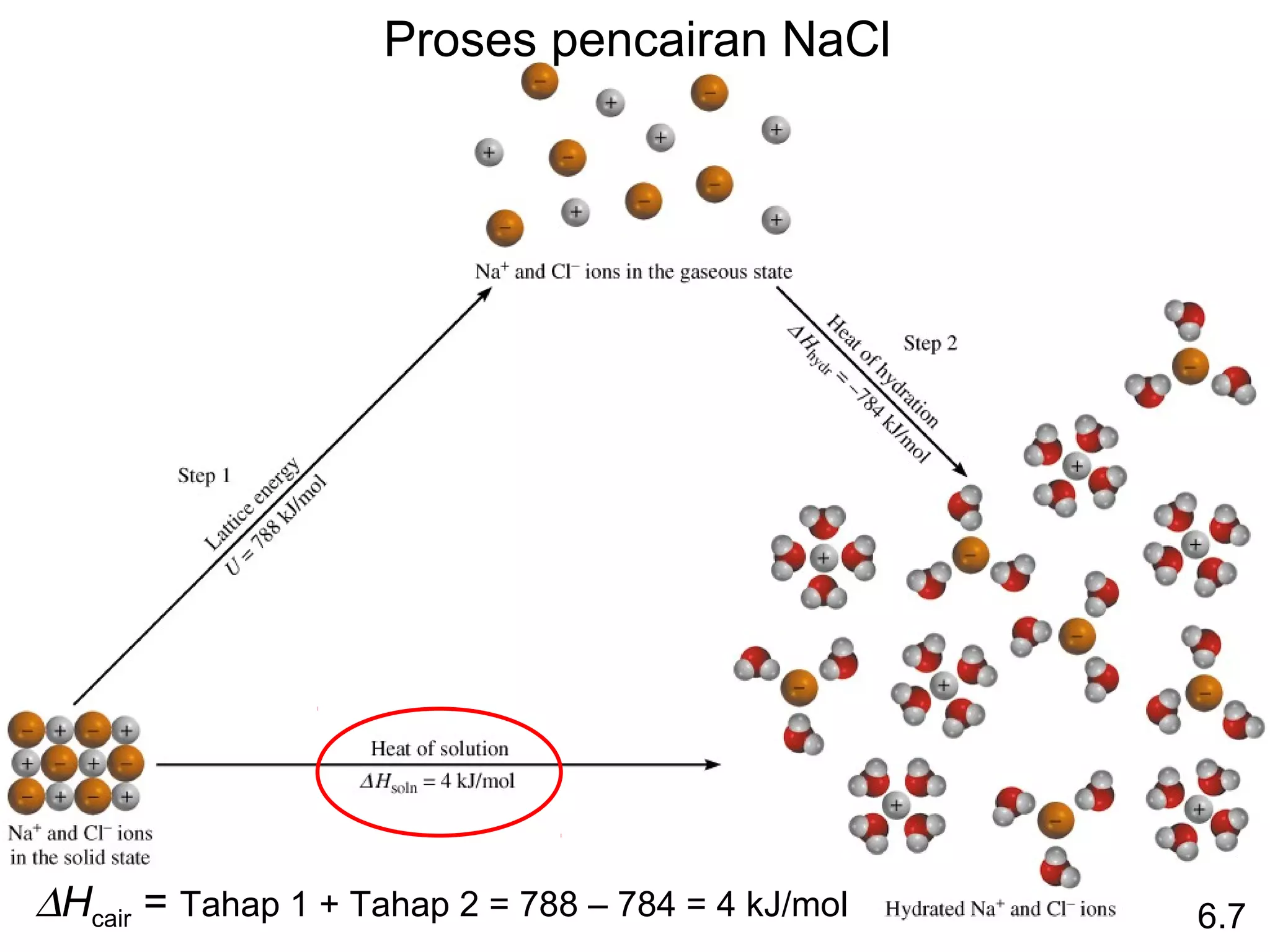
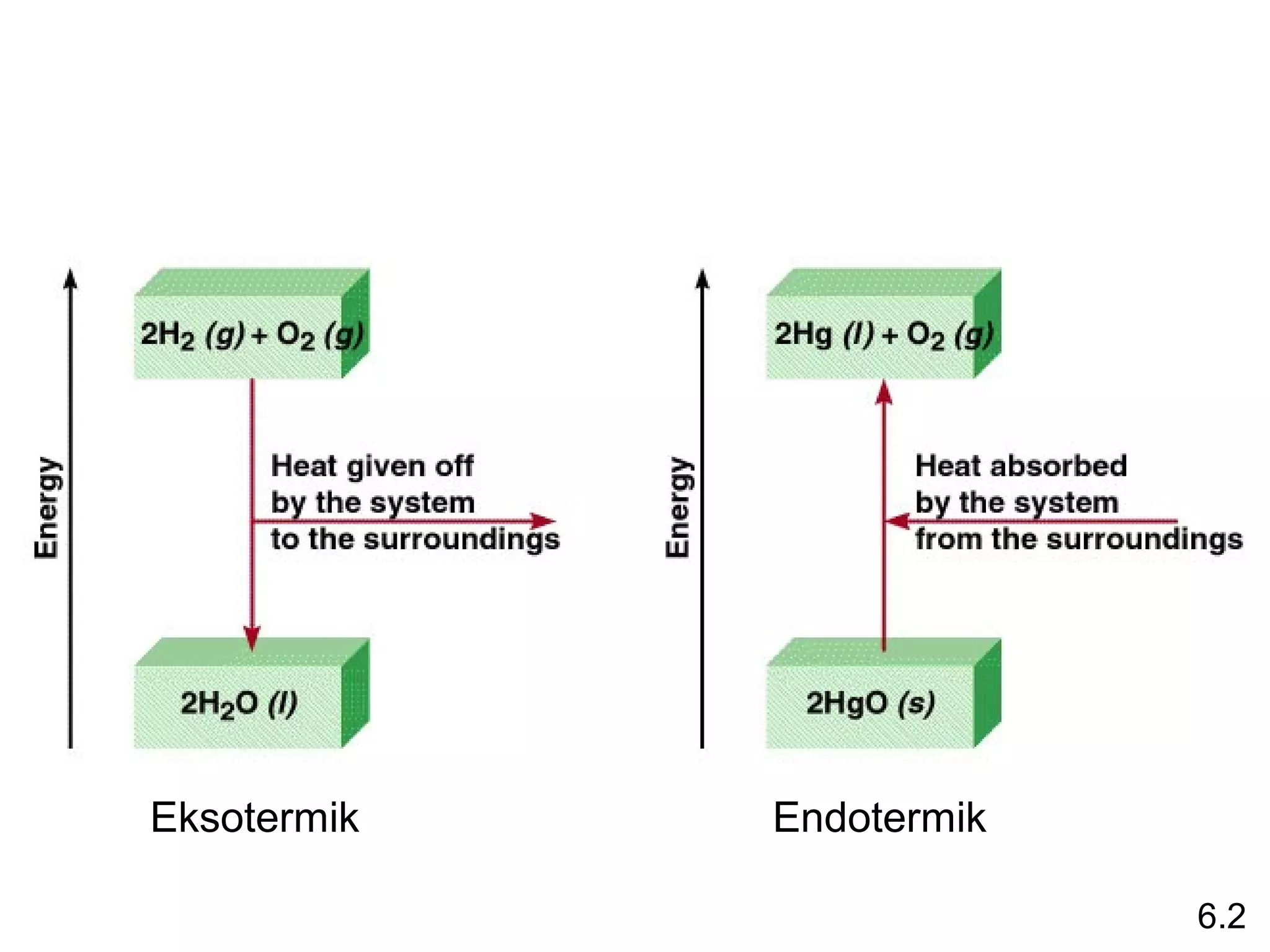
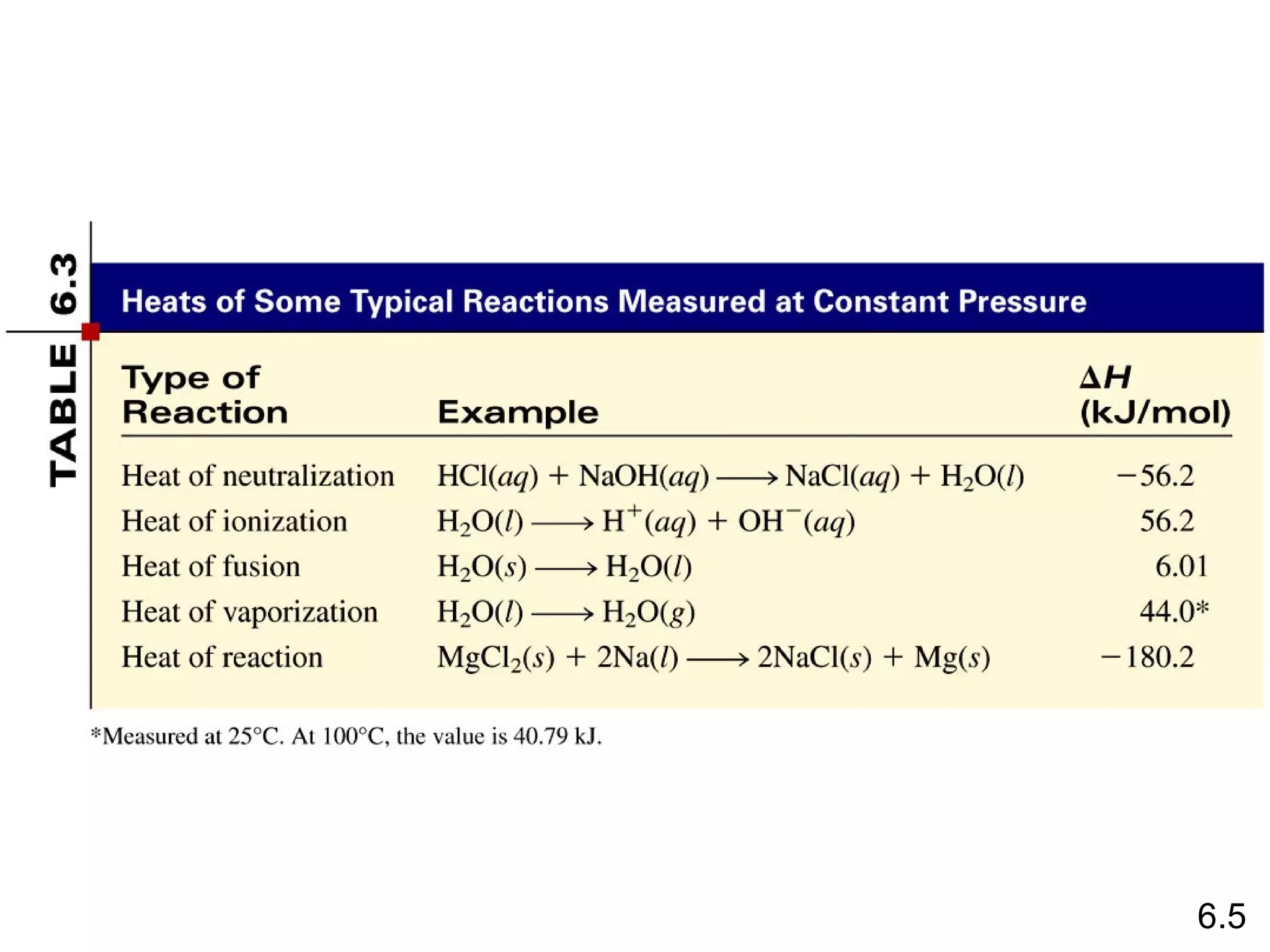
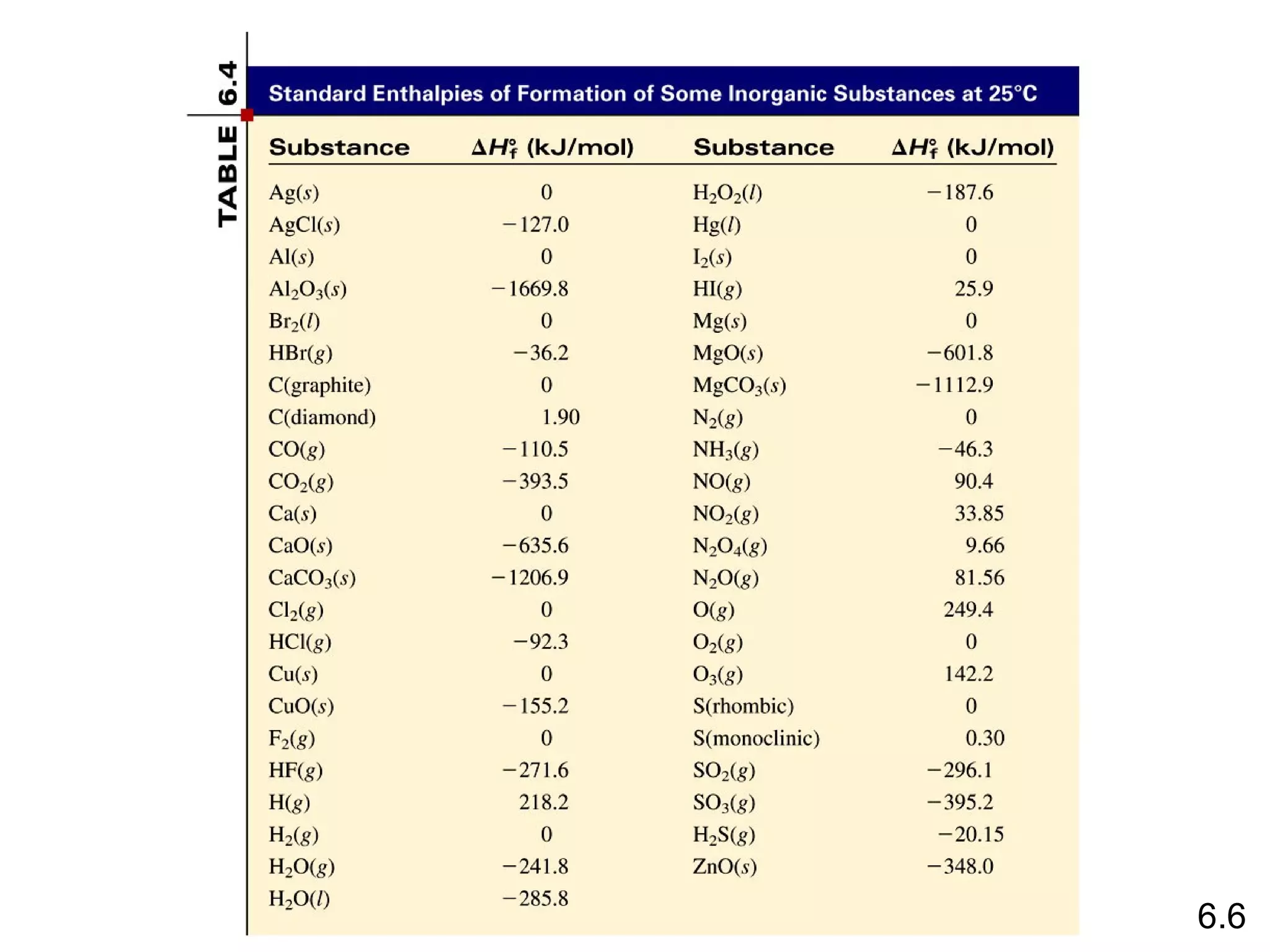
Reaksi pembentukan senyawa CS2 (l) dari unsur karbon grafit dan belerang rombik memiliki entalpi pembentukan standar sebesar -1.072 + 2*(-296,1) - 393,5 = -986,2 kJ/mol. Entalpi pembentukan standar ditentukan dari penjumlahan entalpi reaksi pembentukan produk dan reaktan.


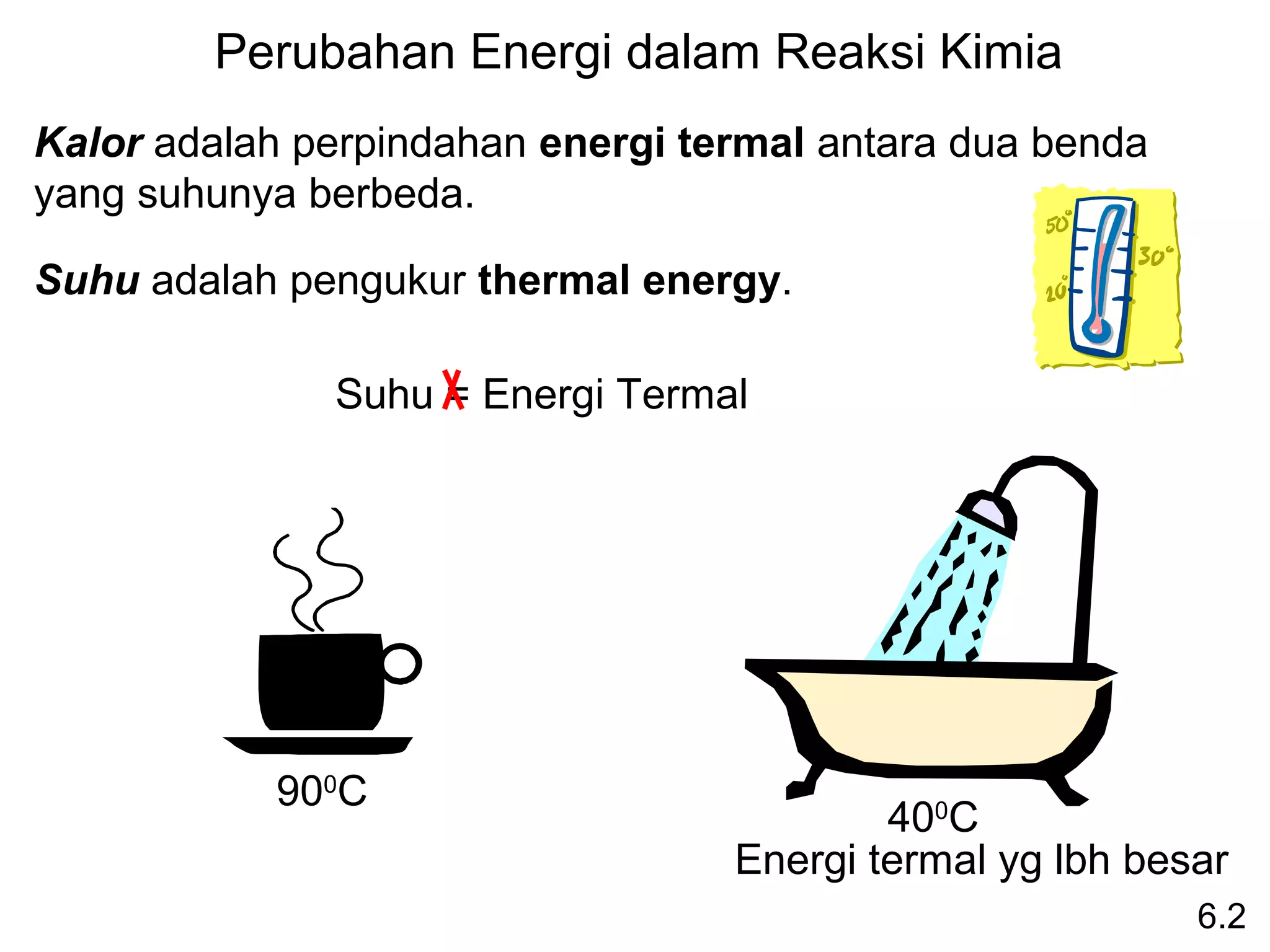
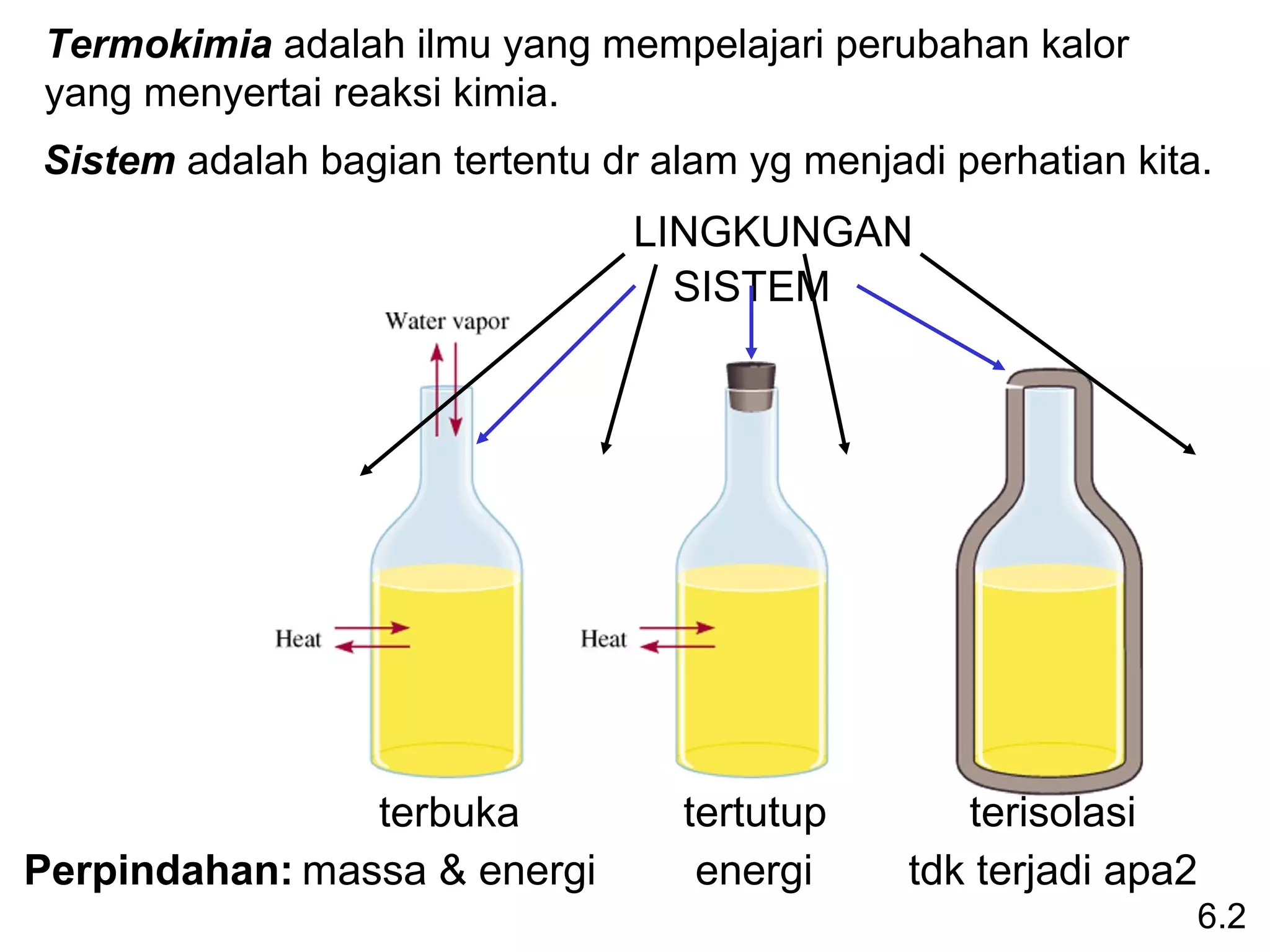
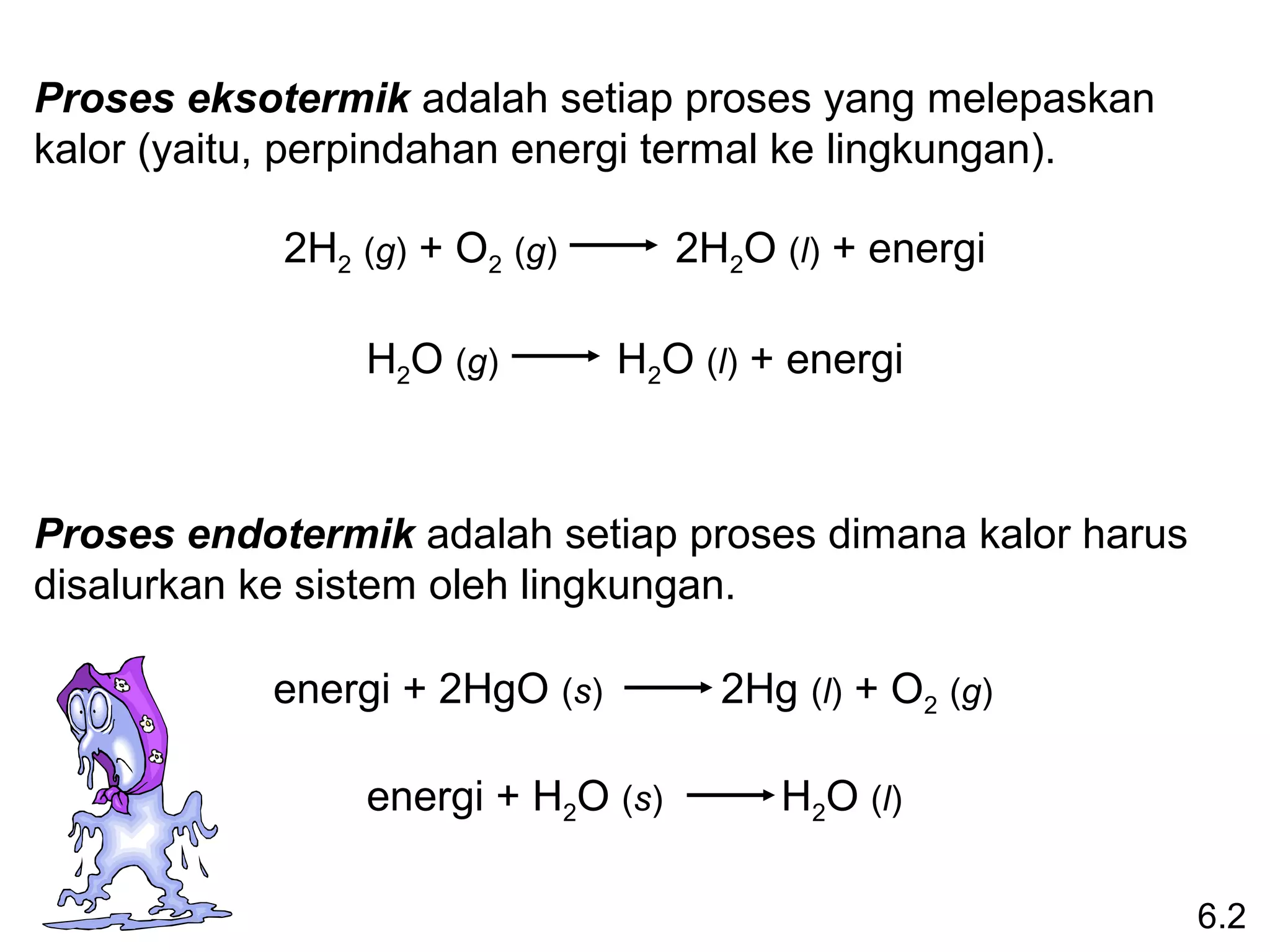











![Entalpi perubahan standar (∆Hreaksi) didefiniskan sebagai
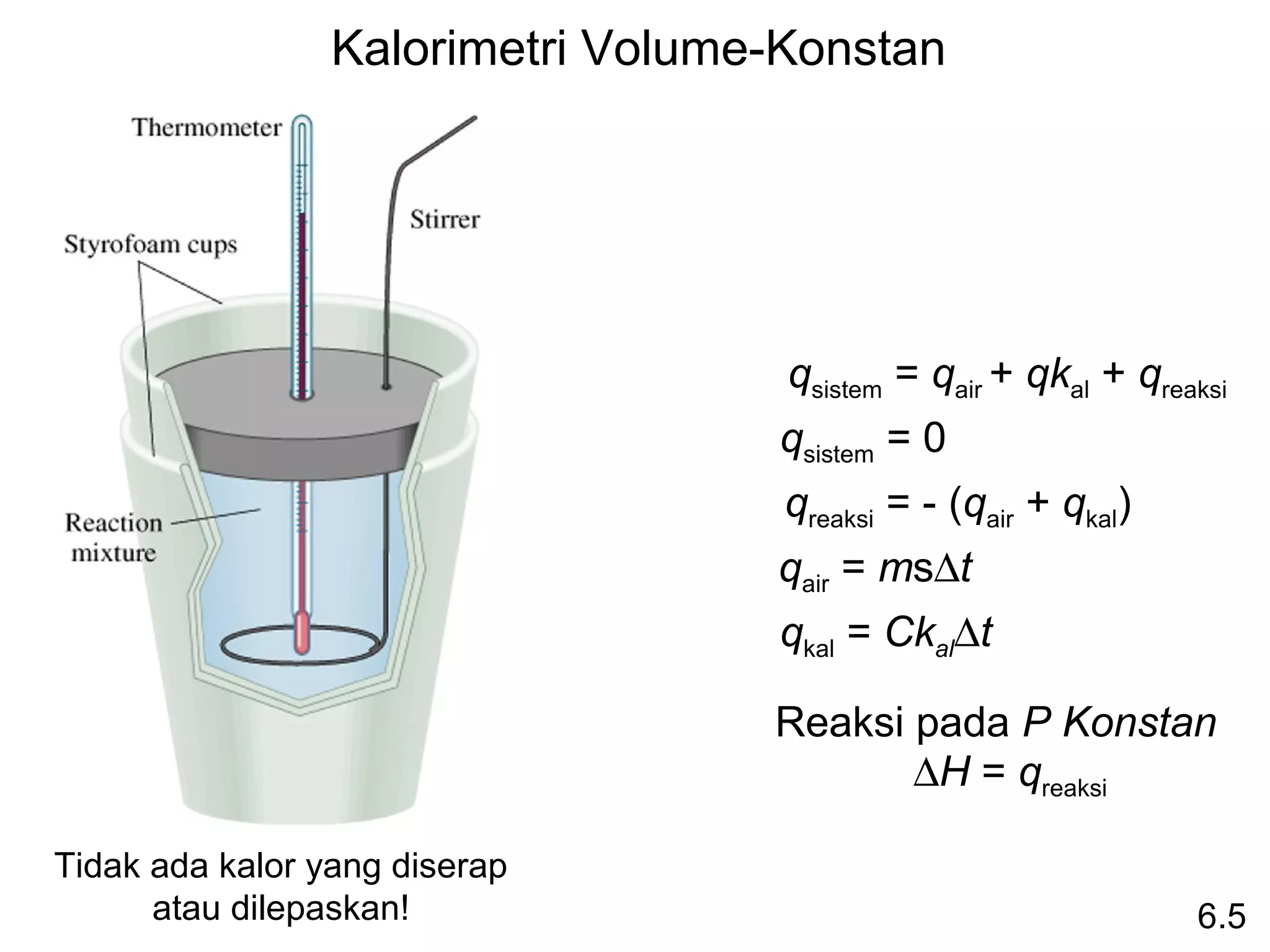
0
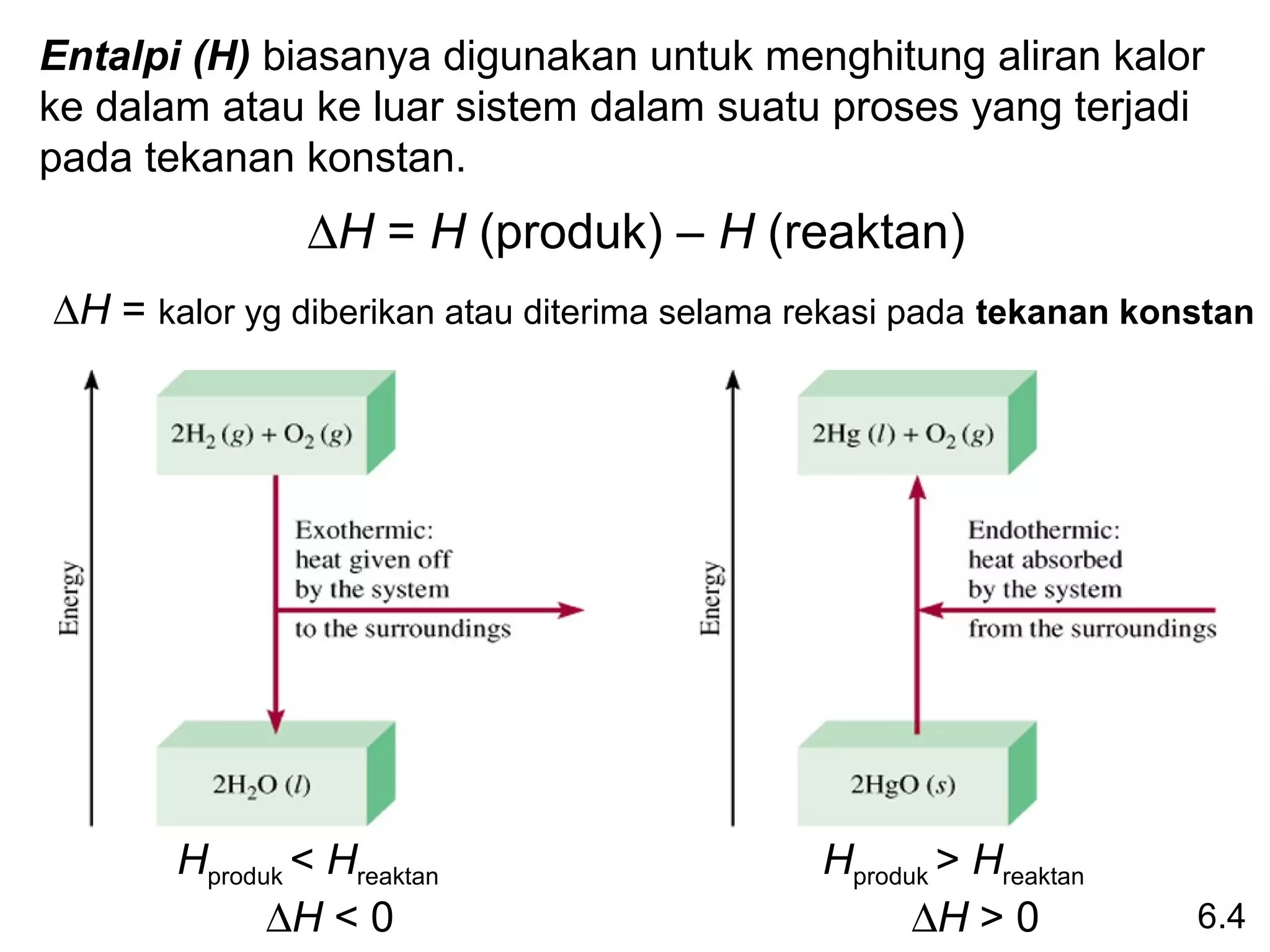
entalpi reaksi yang berlangsung pada tekanan 1 atm.
aA + bB cC + dD
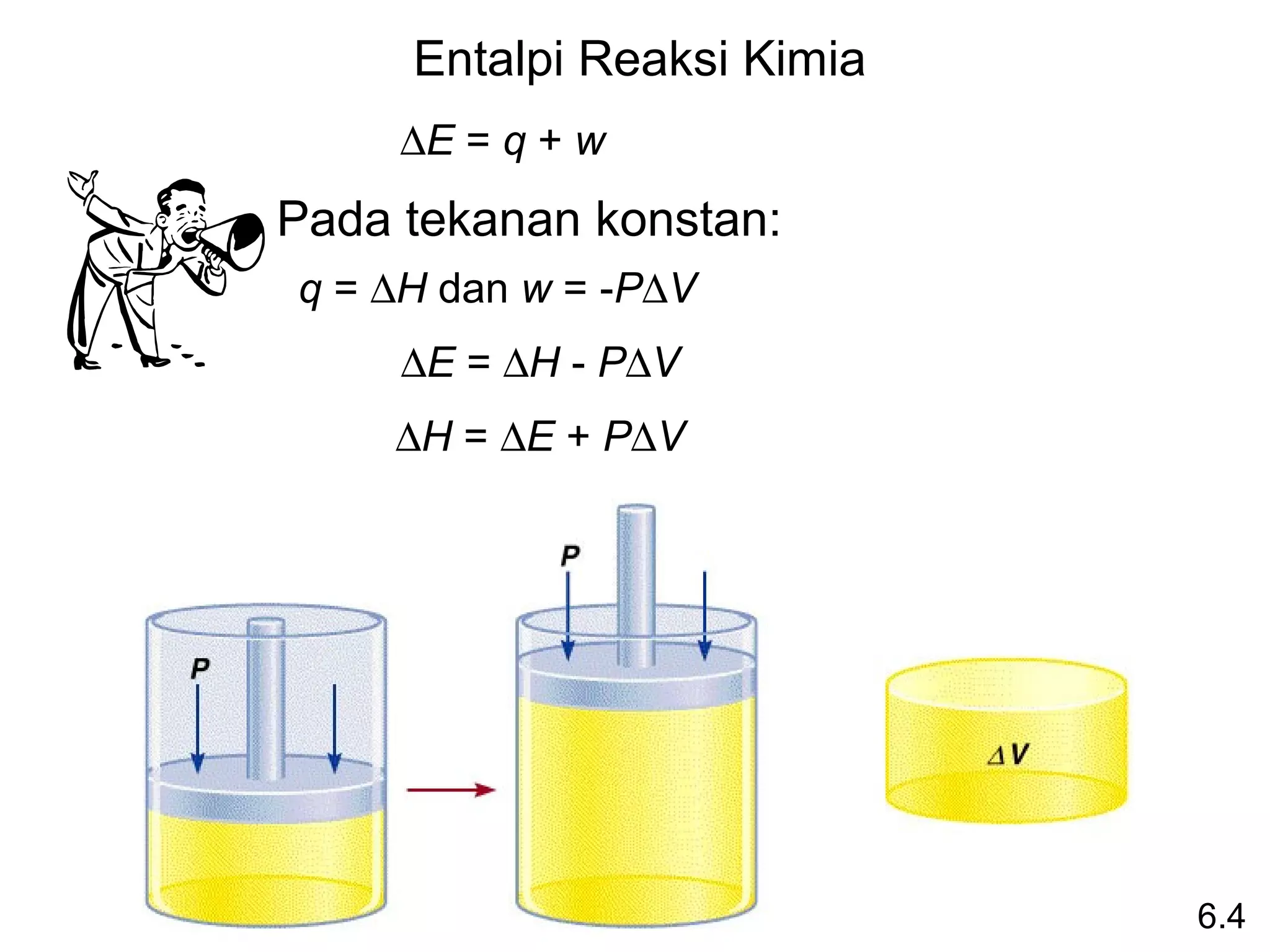
∆Hrxn = [ c∆H0f (C) + d∆H0f (D) ] - [ a∆H0 (A) + b∆H0 (B) ]
0
f f
∆Hrxn = Σ n∆H0f (produk)
0 - Σ m∆Hf0 (reaktan)
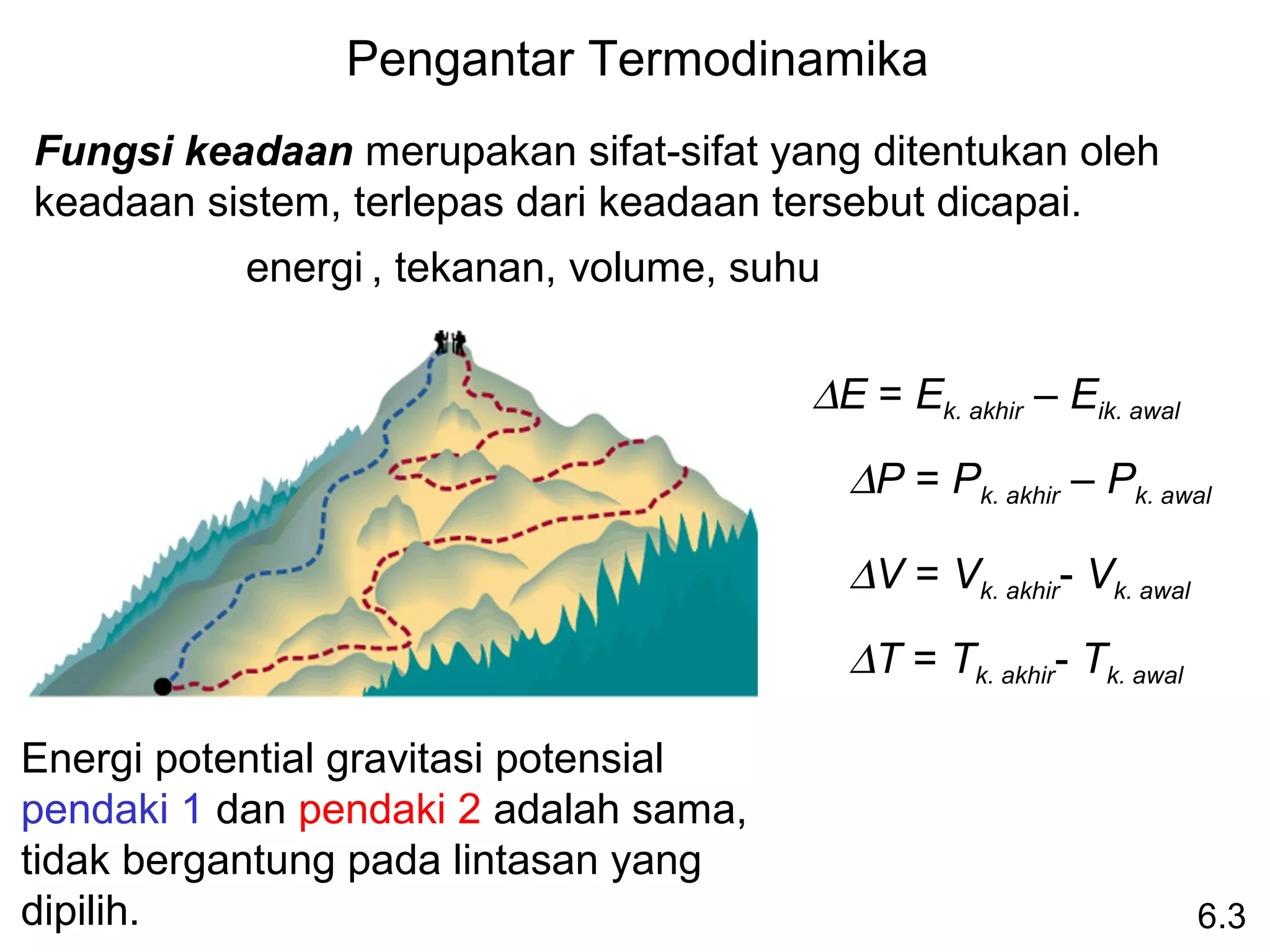
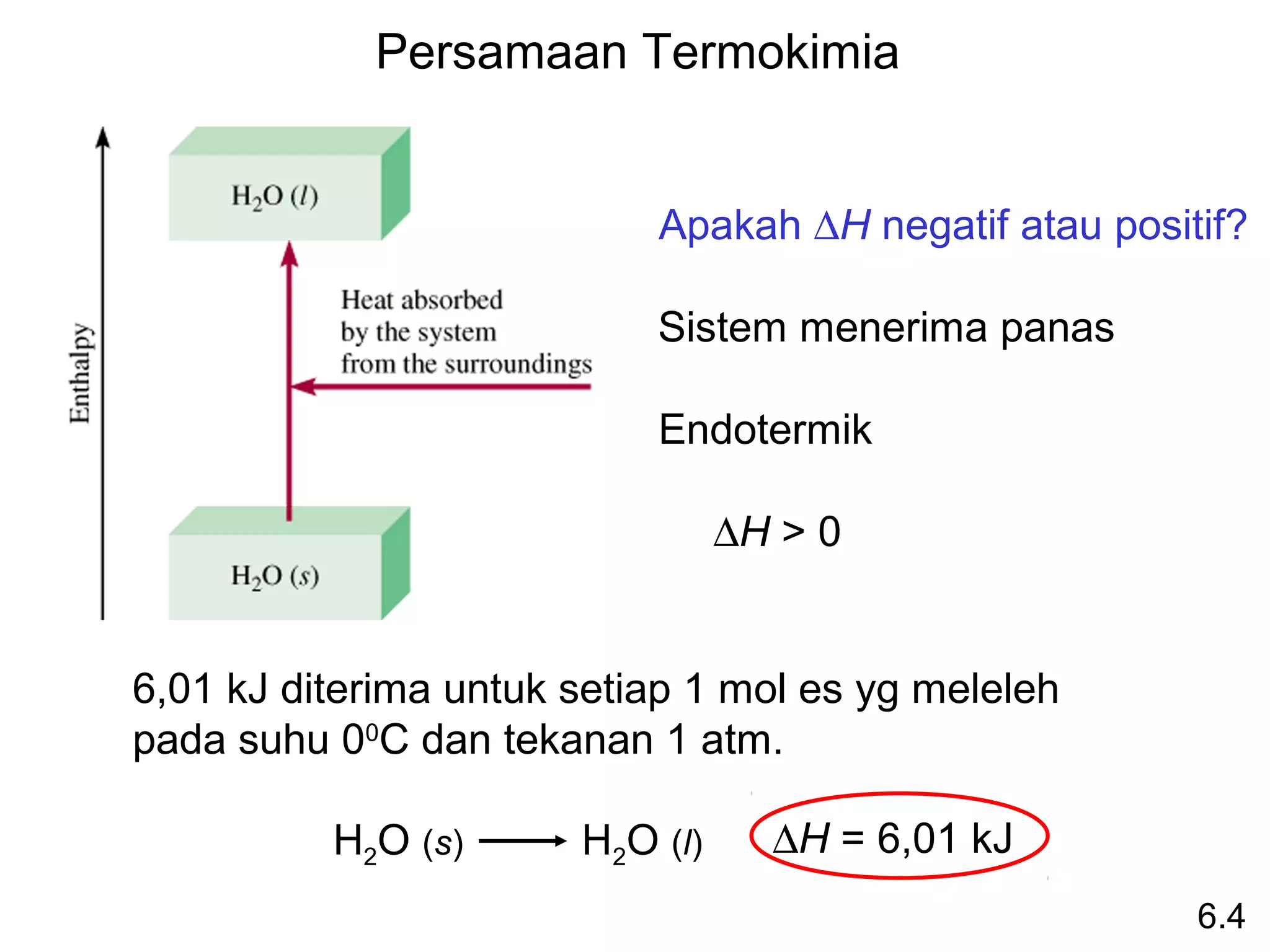
Hukum Hess: bila reaktan diubah menjadi produk,
perubahan entalpinya adalah sama, terlepas apakah reaksi
berlangsung dalam satu tahap atau dalam beberapa tahap.
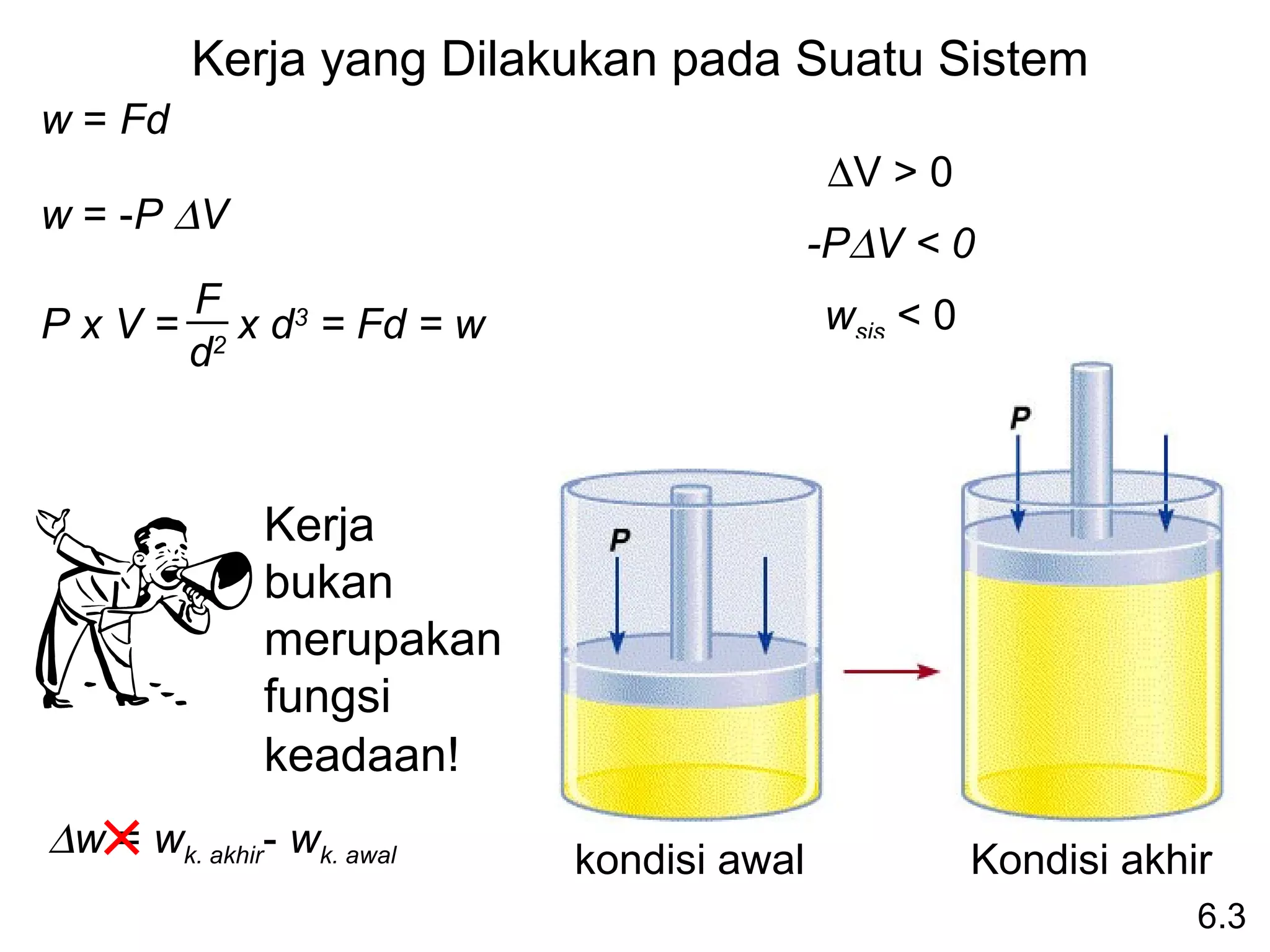
(Entaalpi adalah fungsi keadaan. Tidak peduli bagaimana
caranya, yg dilakukan adalah memulai dan mengakhirinya.)
6.6](https://image.slidesharecdn.com/bab6hubunganenergidalamreaksikimia-121227024928-phpapp02/75/Bab6-hubungan-energi-dalam-reaksi-kimia-28-2048.jpg)

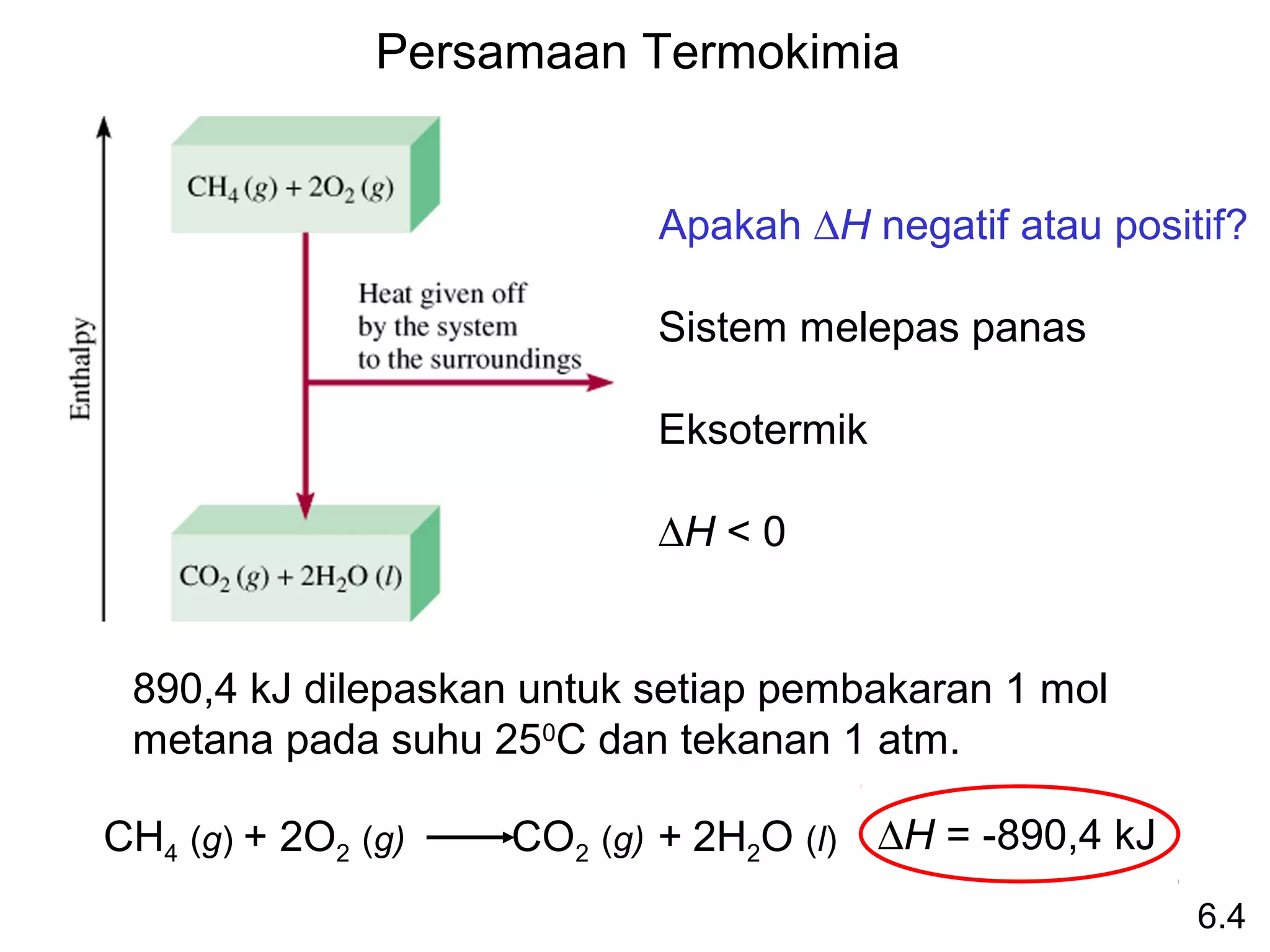
![Benzana (C6H6) terbakar diudara dan menghasilkan
karbon dioksida dan air cair. Berapakah panas yang
dilepaskan per mol oleh pembakaran benzana? Entalpi
pembentukan standar benzana adalah 49,04 kJ/mol.
2C6H6 (l) + 15O2 (g) 12CO2 (g) + 6H2O (l)
∆Hrea = Σ n∆H0f (produk)
0 - Σ m∆Hf0 (reaktan)
∆Hrea = [ 12∆H0 (CO2) + 6∆H0 (H2O)] - [ 2∆Hf0 (C6H6) ]
0
f f
∆Hrea = [ 12x–393,5 + 6x–187.6 ] – [ 2x49,04 ] = -5.946 kJ
0
-5.946 kJ
= - 2.973 kJ/mol C6H6
2 mol
6.6](https://image.slidesharecdn.com/bab6hubunganenergidalamreaksikimia-121227024928-phpapp02/75/Bab6-hubungan-energi-dalam-reaksi-kimia-30-2048.jpg)