Dokumen ini menjelaskan tentang jenis-jenis ikatan kimia, termasuk ikatan ionik, kovalen, hidrogen, dan van der Waals, serta cara mencapai kestabilan melalui berbagai mekanisme pelepasan dan penerimaan elektron. Ikatan ionik terjadi antara logam dan non logam akibat sifat tarik menarik antara kation dan anion, sedangkan ikatan kovalen terjadi melalui berbagi pasangan elektron antara atom-atom non logam. Selain itu, dokumen ini juga membahas karakteristik masing-masing jenis ikatan dan pengaruh keelektronegatifan dalam pembentukan molekul.


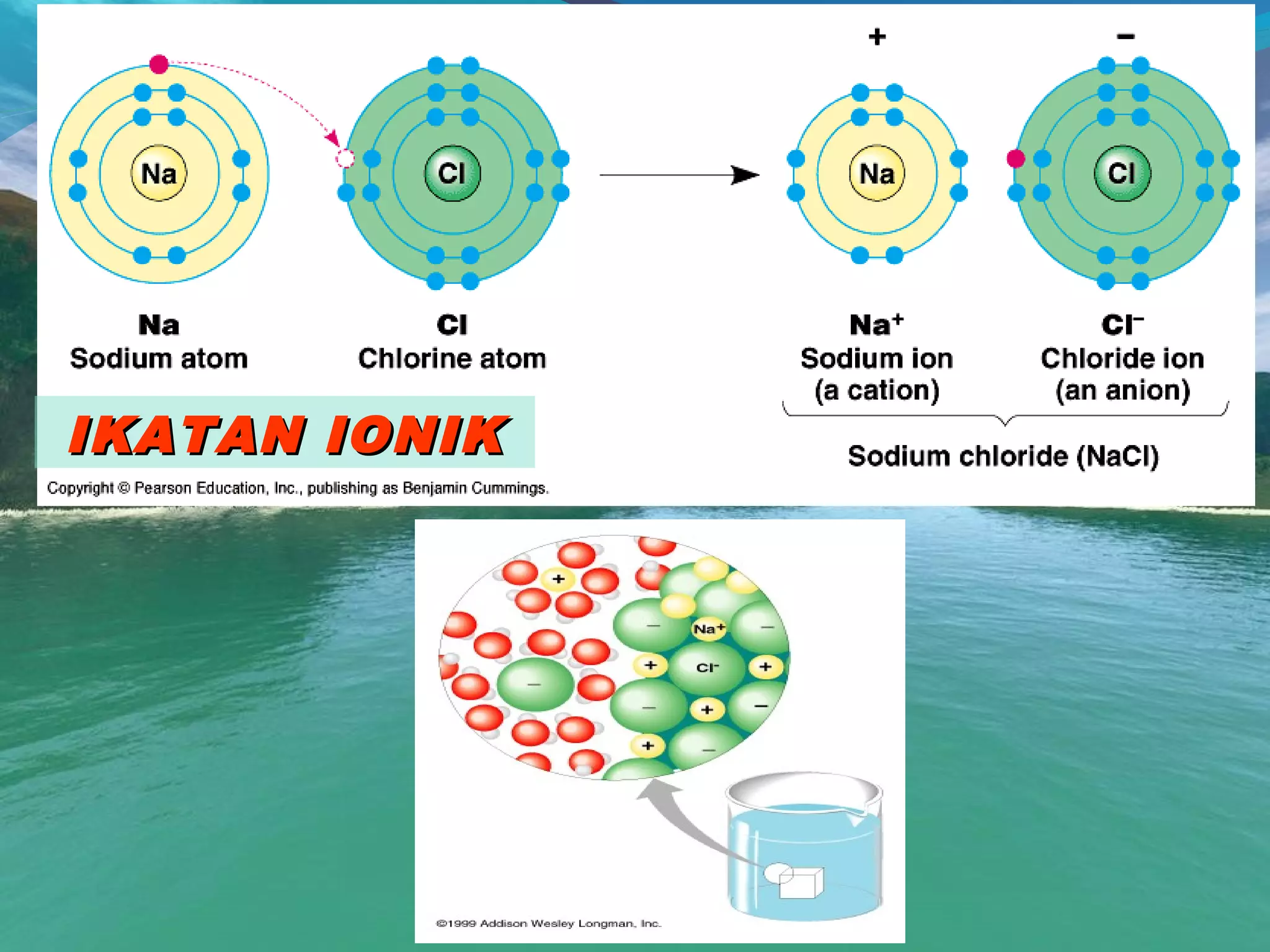
![IKATAN IONIKIKATAN IONIK
Ikatan yang terjadi karena gaya tarik menarik antaraIkatan yang terjadi karena gaya tarik menarik antara
kation dan anion akibat adanya pelepasan dankation dan anion akibat adanya pelepasan dan
penerimaan elektronpenerimaan elektron
Ciri-ciri ikatan ionik:Ciri-ciri ikatan ionik:
a.a. Ada yang melepas dan menerima elektronAda yang melepas dan menerima elektron
b.b. Ikatan antara logam dan non logamIkatan antara logam dan non logam
Contoh: Ikatan pada CaClContoh: Ikatan pada CaCl22
2020Ca : [Ar] 4sCa : [Ar] 4s22
→→ CaCa2+2+
[Ar] + 2e[Ar] + 2e--
|| x 1x 1
1717Cl : [Ne] 3sCl : [Ne] 3s22
3p3p55
+ 1e+ 1e--
→→ ClCl --
: [Ne] 3s: [Ne] 3s22
3p3p66
|| x 2x 2
CaCa + Cl+ Cl22 →→ CaCa2+2+
+ 2Cl+ 2Cl--
→→ CaClCaCl22](https://image.slidesharecdn.com/ikatankimia1-131004235534-phpapp02/75/Ikatan-kimia-3-2048.jpg)